
Apa itu Model Atom Bohr?
Model atom Bohr adalah salah satu model atom yang pertama kali dikemukakan oleh fisikawan Denmark, Niels Bohr pada tahun 1913. Model ini digunakan untuk menjelaskan struktur atom dan cara elektron bergerak di sekitar inti atom. Model atom Bohr juga dikenal sebagai model planet karena elektron-elektron dalam atom bergerak mengelilingi inti atom seperti planet yang mengelilingi matahari.
Model atom Bohr berdasarkan pada beberapa asumsi dasar. Pertama, elektron bergerak dalam orbit melingkar yang terdefinisi secara kuantum di sekitar inti atom. Kedua, elektron hanya dapat bergerak di sejumlah orbit tertentu yang disebut sebagai tingkat energi. Ketiga, ketika elektron bergerak dari satu orbit ke orbit yang lain, energi akan dilepaskan atau diserap. Keempat, elektron yang berada pada tingkat energi tertinggi dianggap sebagai elektron valensi dan berperan dalam membentuk ikatan kimia antara atom-atom.
Tingkat-Tingkat Energi Atom Hidrogen Menurut Model Atom Bohr
Tingkat-tingkat energi atom hidrogen menurut model atom Bohr dapat dijelaskan sebagai berikut:
- Tingkat Energi Dasar (n = 1)
- Tingkat Energi Pertama (n = 2)
- Tingkat Energi Kedua (n = 3)
- …
Ini merupakan tingkat energi terendah pada atom hidrogen dan merupakan tingkat energi dasar. Pada tingkat energi ini, elektron berada dalam orbit terdekat dengan inti atom dan memiliki energi yang paling rendah.
Tingkat energi ini merupakan tingkat energi kedua yang lebih tinggi dibandingkan dengan tingkat energi dasar. Pada tingkat energi ini, elektron berada dalam orbit yang lebih jauh dari inti atom dan memiliki energi yang sedikit lebih tinggi.
Tingkat energi ketiga ini merupakan tingkat energi ketiga yang lebih tinggi dibandingkan dengan tingkat energi pertama dan dasar. Pada tingkat energi ini, elektron berada dalam orbit yang lebih jauh dari inti atom dan memiliki energi yang lebih tinggi lagi.
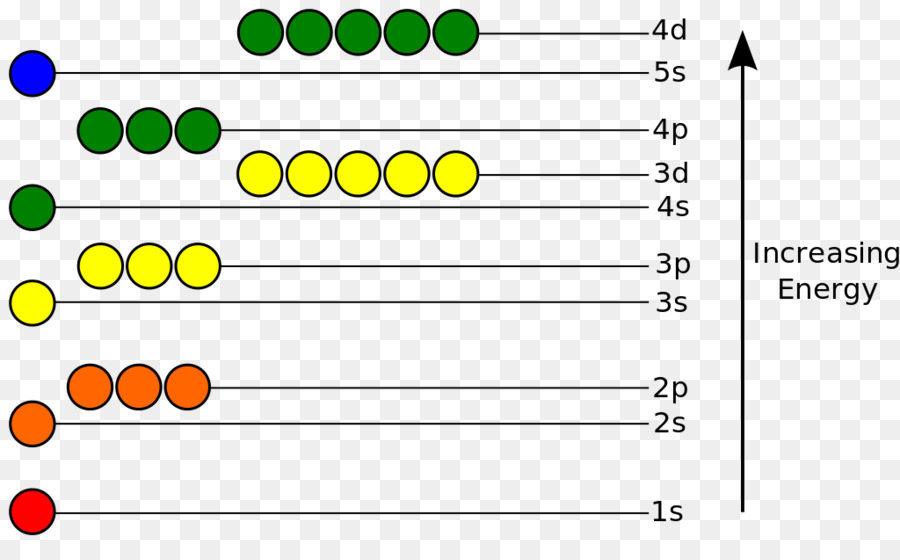
Gambar Tingkat Energi Atom
Dalam model atom Bohr, tingkat energi atom dapat direpresentasikan seperti pada gambar di atas. Setiap tingkat energi diberikan nomor kuantum utama (n) yang menunjukkan jarak elektron dari inti atom. Semakin tinggi nilai n, semakin tinggi pula tingkat energi elektron. Tingkat energi atom ini sangat penting dalam menjelaskan fenomena atom seperti transisi elektronik yang menghasilkan spektrum atomik.


