Apakah kamu tahu tentang reaksi redoks? Reaksi ini sangat penting dalam dunia kimia, dan dalam artikel ini kita akan membahas tentang reaksi redoks, termasuk apa itu, mengapa penting, cara menghitungnya, dan contoh-contoh soal.
Apa Itu Reaksi Redoks?
Reaksi redoks merupakan singkatan dari reaksi reduksi-oksidasi. Reaksi ini terjadi ketika ada perpindahan elektron antara dua zat kimia. Untuk lebih mudahnya, kita dapat menganggap reduksi sebagai penambahan elektron dan oksidasi sebagai pengurangan elektron.
Contoh yang mudah dipahami adalah reaksi antara besi dan oksigen yang membentuk karat pada permukaan besi. Pada reaksi tersebut, besi (Fe) kehilangan elektron dan menjadi Fe2+, sehingga mengalami oksidasi. Sedangkan oksigen (O2) mendapatkan elektron dan menjadi O2-, sehingga mengalami reduksi.
Mengapa Reaksi Redoks Penting?
Reaksi redoks sangat penting dalam kehidupan sehari-hari karena banyak terjadi pada proses-proses di sekitar kita, seperti proses pengolahan makanan, penyimpanan baterai, dan bahkan dalam proses bernapas.
Di dalam dunia industri, reaksi redoks juga digunakan untuk proses pengolahan bijih, pembuatan kertas, dan pemurnian logam. Selain itu, reaksi redoks juga sangat penting dalam teknologi bahan bakar alternatif seperti sel bahan bakar.
Cara Menghitung Reaksi Redoks
Ada beberapa cara untuk menghitung reaksi redoks, yaitu dengan menghitung bilangan oksidasi zat-zat yang terlibat dalam reaksi, atau dengan menggunakan tabel potensial standar.
Untuk menghitung bilangan oksidasi, pertama kita harus mengetahui konfigurasi elektron suatu unsur. Dari konfigurasi tersebut, kita dapat memprediksi bilangan oksidasi unsur tersebut dalam suatu senyawa atau ion. Misalnya, pada ion sulfat (SO42-), kita dapat mengetahui bahwa bilangan oksidasi sulfur (S) adalah +6.
Selain menggunakan bilangan oksidasi, kita juga dapat menggunakan tabel potensial standar untuk menghitung reaksi redoks. Di dalam tabel tersebut, terdapat nilai potensial elektroda dari suatu zat yang berhubungan dengan kemampuan zat tersebut untuk menerima atau melepaskan elektron. Dengan menggunakan tabel potensial standar, kita dapat memprediksi apakah suatu reaksi akan terjadi atau tidak, serta kekuatan zat reduktor maupun oksidator yang terlibat dalam reaksi tersebut.
Contoh Soal Reaksi Redoks
Berikut ini adalah beberapa contoh soal tentang reaksi redoks:
Contoh 1
Perhatikan reaksi redoks berikut:
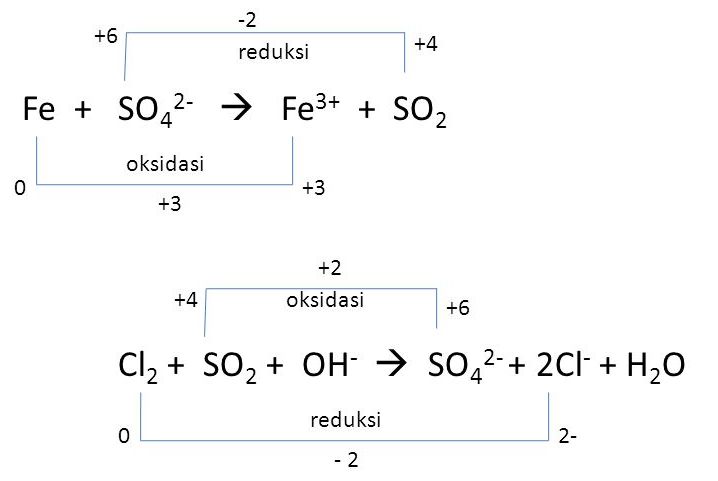
Tentukan apakah reaksi tersebut adalah reaksi reduksi atau oksidasi, dan tentukan juga bilangan oksidasi unsur-unsur yang terlibat dalam reaksi.
Penyelesaian:
Reaksi tersebut merupakan reaksi reduksi karena pada reaksi tersebut terdapat suatu zat yang mengalami reduksi, yaitu Ag+. Bilangan oksidasi Ag+ adalah +1, sedangkan bilangan oksidasi Cu adalah +2.
Contoh 2
Saat proses pengisian aki, terjadi reaksi redoks antara Pb dan PbO2 yang menghasilkan PbSO4 dan air. Tuliskan reaksi redoks lengkap!
Penyelesaian:
Reaksi redoksnya adalah:

Agar lebih mudah dipahami, kita dapat memisahkan reaksi tersebut menjadi dua reaksi parsial:
Reaksi oksidasi: Pb → PbSO4 + 2 e-
Reaksi reduksi: PbO2 + 4 e- + 2 H2SO4 → PbSO4 + 2 H2O
Dari kedua reaksi parsial tersebut, kita dapat menulis reaksi redoksnya:
Pb + PbO2 + 4 H2SO4 → 2 PbSO4 + 2 H2O
Itulah beberapa contoh soal tentang reaksi redoks. Jika kamu ingin lebih memahami tentang reaksi redoks, kamu bisa belajar lebih lanjut dengan membaca buku-buku atau mengikuti kelas-kelas tentang kimia.




