Perubahan entalpi pembentukan standar adalah perubahan entalpi yang terjadi saat satu mol zat dibentuk dari unsur-unsurnya dalam keadaan standar. Perubahan entalpi ini sering digunakan untuk menghitung reaksi termodinamika. Berikut adalah contoh dan cara menghitung perubahan entalpi pembentukan standar.
Contoh Perubahan Entalpi Pembentukan Standar
Berikut adalah salah satu contoh soal perubahan entalpi pembentukan standar:

Apa itu Perubahan Entalpi Pembentukan Standar?
Perubahan entalpi pembentukan standar adalah perubahan entalpi yang terjadi saat satu mol zat dibentuk dari unsur-unsurnya dalam keadaan standar. Entalpi pembentukan standar yaitu mengacu pada entalpi pembentukan suatu zat dari unsur-unsurnya pada keadan standar, yaitu dengan tekanan satu atmosfer dan suhu 25 derajat Celcius.
Mengapa Perubahan Entalpi Pembentukan Standar Penting?
Perubahan entalpi pembentukan standar penting dalam kimia, karena dapat menjadi acuan dalam menghitung reaksi termodinamika. Sebagai contoh, jika kita ingin mengetahui entalpi reaksi pembentukan asam sulfat dari sulfur dan oksigen, maka kita dapat menggunakan perubahan entalpi pembentukan standar untuk sulfur dan oksigen serta asam sulfat.
Cara Menghitung Perubahan Entalpi Pembentukan Standar
Setelah mengetahui apa itu perubahan entalpi pembentukan standar, berikut adalah beberapa cara menghitungnya:
- Tentukan reaksi yang akan dihitung. Misalnya, reaksi pembentukan air dari hidrogen dan oksigen.
- Tentukan persamaan reaksi kimia dan hitung jumlah mol dari reaktan dan produk.
- Tentukan perubahan entalpi pembentukan standar untuk setiap reaktan dan produk.
- Hitung perubahan entalpi pembentukan standar untuk reaksinya dengan menggunakan besaran stoikiometri.
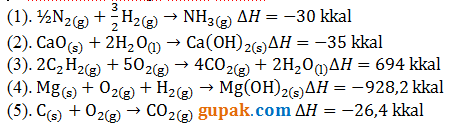
Contoh Penghitungan Perubahan Entalpi Pembentukan Standar
Selanjutnya, berikut adalah contoh perhitungan perubahan entalpi pembentukan standar untuk reaksi pembentukan air dari hidrogen dan oksigen:

- Reaksi: 2H2 (g) + O2 (g) -> 2H2O (l)
- Jumlah mol: 2 mol H2, 1 mol O2, dan 2 mol H2O
- Perubahan entalpi pembentukan standar:
- ∆H pembentukan standar H2 (g) = 0 kJ/mol
- ∆H pembentukan standar O2 (g) = 0 kJ/mol
- ∆H pembentukan standar H2O (l) = -285.8 kJ/mol
- Perubahan entalpi pembentukan standar reaksi:
- 2(0 kJ/mol) + 1(0 kJ/mol) – 2(-285.8 kJ/mol) = -571.6 kJ/mol
Dalam contoh di atas, ∆H pembentukan standar reaksi pembentukan air dari hidrogen dan oksigen adalah -571.6 kJ/mol, yang menunjukkan bahwa reaksi ini melepaskan panas.
Dengan memahami cara menghitung perubahan entalpi pembentukan standar, kita dapat menghitung reaksi termodinamika secara lebih akurat dan memprediksi sifat-sifat suatu zat.