Unsur 8a Terletak Dalam Satu Golongan – Berbagai Unsur
Apa Itu Unsur 8a?

Unsur 8a, juga dikenal sebagai grup 18 atau unsur gas mulia, adalah salah satu golongan unsur dalam sistem periodik. Unsur dalam golongan ini termasuk helium (He), neon (Ne), argon (Ar), kripton (Kr), xenon (Xe), dan radon (Rn). Karakteristik utama dari unsur-unsur ini adalah bahwa mereka memiliki beberapa elektron valensi di kulit terluar mereka dan karena itu cenderung memiliki reaktivitas yang sangat rendah.
Keuntungan Unsur 8a
Golongan unsur 8a memiliki beberapa keuntungan yang penting dalam berbagai aspek kehidupan kita. Salah satu keuntungan utama adalah kestabilan dan ketahanan mereka terhadap reaksi kimia. Karena unsur-unsur dalam golongan ini memiliki kulit elektron terluar yang penuh, mereka tidak cenderung berikatan dengan unsur lain untuk mencapai kestabilan. Ini membuat mereka tidak mudah terlibat dalam reaksi kimia dan juga membuatnya menjadi pilihan yang aman untuk digunakan dalam berbagai aplikasi industri yang membutuhkan kestabilan kimia.
Kekurangan Unsur 8a
Meskipun memiliki keuntungan yang signifikan, unsur-unsur golongan 8a juga memiliki beberapa kekurangan. Salah satu kekurangan utama adalah ketidakreaktivan mereka yang sangat tinggi. Karena elektron valensi mereka sudah penuh, mereka cenderung tidak terlibat dalam reaksi kimia dengan unsur lain. Ini membuatnya sulit untuk digunakan dalam sintesis komponen kimia baru atau dalam reaksi kimia yang diperlukan untuk berbagai proses industri.
Cara Menggunakan Unsur 8a
Penggunaan utama unsur-unsur golongan 8a adalah dalam industri penerangan. Neon, misalnya, digunakan dalam lampu neon yang populer untuk reklame dan penandaan jalan. Kripton dan xenon digunakan dalam lampu sorot, seperti yang sering kita lihat di stadion atau gedung pertunjukan. Keuntungan utama menggunakan gas mulia dalam lampu adalah karena mereka tidak mudah terbakar dan memberikan cahaya yang stabil dan terang.
Pemesanan Unsur 8a
Jika Anda memerlukan unsur-unsur golongan 8a untuk kebutuhan Anda, Anda dapat menghubungi pemasok kimia terpercaya. Pastikan untuk mencari pemasok yang memiliki sertifikasi dan standar yang baik dalam menyediakan bahan kimia berkualitas, terutama untuk aplikasi industri yang membutuhkan kestabilan tinggi dan kemurnian unsur.
Lokasi Tambang Unsur 8a
Unsur-unsur golongan 8a, seperti helium dan argon, dapat ditemukan di alam dalam jumlah yang terbatas. Biasanya, mereka diekstraksi dari gas alam atau udara sebagai hasil sampingan dari proses pemisahan udara. Beberapa tempat di dunia yang memiliki penambangan helium dan argon yang signifikan termasuk Amerika Serikat, Kanada, Rusia, dan Israel.
Energi Ionisasi: Pengertian Energi Ionisasi d – UtakAtikOtak.com
Apa Itu Energi Ionisasi?
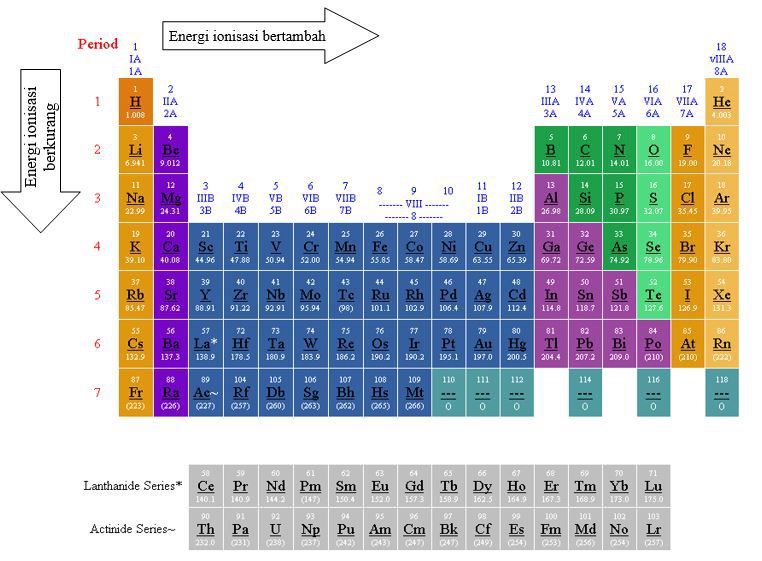
Energi ionisasi adalah energi yang diperlukan untuk mengionisasi sebuah atom atau molekul, yaitu menghilangkan satu atau lebih elektron dari sistem atomik atau molekul tersebut. Proses ionisasi ini biasanya terjadi ketika atom atau molekul terkena radiasi elektromagnetik, seperti sinar matahari atau sinar UV, atau ketika mereka berinteraksi dengan partikel bermuatan seperti ion atau elektron.
Keuntungan Energi Ionisasi
Energi ionisasi memiliki beberapa keuntungan penting dalam berbagai bidang ilmu pengetahuan dan teknologi. Salah satu keuntungan utamanya adalah kemampuannya untuk membantu dalam analisis komposisi kimia suatu zat. Dengan mengukur energi ionisasi suatu zat, kita dapat mengidentifikasi jenis dan jumlah atom atau molekul yang ada dalam zat tersebut. Ini penting dalam kimia analitik dan industri farmasi, di mana identifikasi zat yang ada sangat penting untuk memastikan kualitas dan keamanan produk.
Kekurangan Energi Ionisasi
Meskipun memiliki keuntungan yang signifikan, energi ionisasi juga memiliki beberapa kekurangan. Salah satu kekurangan utama adalah bahwa untuk mengionisasi atom atau molekul, energi yang diperlukan seringkali cukup tinggi. Ini berarti bahwa proses ionisasi mungkin memerlukan sumber energi tambahan, seperti panas atau listrik, untuk mencapai energi ionisasi yang diperlukan. Selain itu, proses ionisasi juga dapat menyebabkan kerusakan pada struktur atomik atau molekul, yang dapat mempengaruhi sifat dan kualitas zat tersebut.
Cara Mengukur Energi Ionisasi
Ada beberapa metode yang digunakan untuk mengukur energi ionisasi sebuah zat. Salah satu metode yang umum digunakan adalah spektroskopi ionisasi fotoelektron (PES). Dalam teknik ini, molekul atau atom diionisasi dengan menggunakan sinar ultraviolet atau sinar-x tinggi. Elektron yang terionisasi kemudian dideteksi dan energi ionisasi dapat dihitung berdasarkan energi yang diperlukan untuk mengionisasi elektron tersebut.
Pemesanan Energi Ionisasi
Pada dasarnya, energi ionisasi tidak bisa dipesan seperti barang fisik. Namun, Anda dapat mengakses data energi ionisasi dari berbagai sumber terpercaya di internet atau melalui literatur ilmiah. Dalam memperoleh data ini, pastikan Anda merujuk pada sumber yang dapat dipercaya dan memiliki metodologi pengukuran yang baik untuk memastikan keakuratan data yang Anda gunakan.
Lokasi Percobaan Energi Ionisasi
Percobaan tentang energi ionisasi biasanya dilakukan di laboratorium kimia atau fisika yang dilengkapi dengan peralatan yang diperlukan untuk melakukan pengukuran dan analisis. Banyak universitas atau institusi penelitian yang melakukan penelitian dalam bidang ini dan memiliki fasilitas yang diperlukan untuk eksperimen energi ionisasi. Beberapa tempat penelitian terkemuka di dunia dalam bidang ini termasuk Harvard University di Amerika Serikat, University of Cambridge di Inggris, dan Max Planck Institute di Jerman.
Rumus energi ionisasi elektron dan perubahan energi elektron – cekrisna
Apa Itu Rumus Energi Ionisasi Elektron?
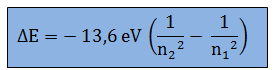
Rumus energi ionisasi elektron adalah formula matematika yang digunakan untuk menghitung energi yang diperlukan untuk mengionisasi sebuah atom atau molekul dengan melepaskan satu elektron valensi. Rumus ini bergantung pada beberapa faktor, termasuk muatan atom, jarak antara nukleus dan elektron, serta keadaan elektron sebelum dan setelah ionisasi.
Perubahan Energi Elektron
Rumus perubahan energi elektron diperoleh dengan mengurangi energi elektron awal dari energi elektron setelah ionisasi. Perubahan energi elektron positif jika elemen kehilangan elektron dan negatif jika elemen mendapatkan elektron dalam proses ionisasi. Perubahan energi elektron bergantung pada kerapatan muatan pada nukleus dan konsentrasi elektron pada tingkat energi tertentu.
Penggunaan Rumus Energi Ionisasi Elektron
Rumus energi ionisasi elektron digunakan dalam berbagai aspek ilmu pengetahuan dan teknologi. Dalam kimia analitik, rumus ini digunakan untuk mengidentifikasi komposisi kimia suatu zat dengan mengukur energi yang diperlukan untuk mengionisasi atom atau molekul dalam zat tersebut. Ini memungkinkan kita untuk menentukan jenis dan jumlah atom atau molekul yang ada dalam zat tersebut dengan bantuan rumus tersebut.
Pemesanan dan Penggunaan Rumus Energi Ionisasi Elektron
Rumus energi ionisasi elektron dapat digunakan secara bebas oleh siapa saja yang mempelajari ilmu kimia atau fisika. Untuk menggunakan rumus ini, Anda perlu mengetahui muatan atom atau molekul yang akan diionisasi, jarak antara nukleus dan elektron, serta keadaan energi awal dan akhir dari elektron tersebut. Dengan informasi ini, Anda dapat menghitung energi ionisasi elektron menggunakan rumus yang sudah ditentukan.
Lokasi Penelitian Rumus Energi Ionisasi Elektron
Penelitian tentang rumus energi ionisasi elektron umumnya dilakukan di laboratorium fisika atau kimia yang dilengkapi dengan peralatan yang diperlukan untuk melakukan pengukuran dan analisis. Banyak universitas atau institusi penelitian di seluruh dunia yang melakukan penelitian dalam bidang ini dan memiliki fasilitas yang diperlukan untuk melakukan eksperimen energi ionisasi elektron. Beberapa tempat penelitian terkemuka di dunia dalam bidang ini termasuk California Institute of Technology di Amerika Serikat, University of Oxford di Inggris, dan National University of Singapore di Singapura.


