Halaman ini akan menjelaskan perbedaan antara rumus empiris dan rumus molekul serta memberikan contoh soal. Sebelum membahas lebih jauh, ada baiknya kita memahami terlebih dahulu definisi dari keduanya.
Rumus Empiris
Rumus empiris menggambarkan komposisi relatif berat atom-atom yang membentuk suatu senyawa dengan menggunakan bilangan bulat terkecil. Rumus empiris memberikan informasi mengenai perbandingan atom dalam suatu senyawa. Contohnya, rumus empiris air adalah H2O, yang berarti terdapat dua atom hidrogen (H) dan satu atom oksigen (O) dalam setiap molekul air.

Apa itu rumus empiris? Rumus empiris adalah representasi sederhana dari susunan atom-atom dalam suatu senyawa. Dalam rumus empiris, perbandingan atom diwakili oleh bilangan bulat terkecil yang mungkin.
Cara menentukan rumus empiris dapat dilakukan melalui beberapa langkah berikut:
- Menentukan massa atau persentase massa atom-atom yang terlibat dalam suatu senyawa.
- Mengubah massa atau persentase massa atom menjadi mol.
- Membagi setiap bilangan mol dengan bilangan mol terkecil untuk mendapatkan perbandingan mol yang sederhana.
- Menggandakan rasio bilangan mol dengan bilangan terkecil untuk mendapatkan rumus empiris.
Definisi rumus empiris dapat disimpulkan sebagai representasi sederhana dari komposisi atom dalam suatu senyawa dengan menggunakan bilangan bulat terkecil yang mungkin.
Proses menentukan rumus empiris dapat diilustrasikan melalui contoh berikut:
- Dalam suatu senyawa, massa hidrogen (H) adalah 1 gram dan massa oksigen (O) adalah 16 gram.
- Mengubah massa atom menjadi mol, mengingat massa atom H = 1 gram/mol dan massa atom O = 16 gram/mol.
- Jumlah mol hidrogen = 1 mol / 1 mol/gram = 1 mol
- Jumlah mol oksigen = 16 mol / 16 mol/gram = 1 mol
- Setiap bilangan mol dibagi dengan bilangan mol terkecil, yaitu 1 mol.
- Perbandingan mol hidrogen = 1 mol / 1 mol = 1
- Perbandingan mol oksigen = 1 mol / 1 mol = 1
- Maka, rumus empiris dari senyawa tersebut adalah H1O1, yang dapat disederhanakan menjadi H2O.
Hasil yang diperoleh dari perhitungan rumus empiris adalah H2O, yang sesuai dengan rumus molekul air yang sudah diketahui sebelumnya. Rumus empiris dapat memberikan informasi yang sangat berguna dalam memahami komposisi relatif atom dalam suatu senyawa.
Berikut ini adalah contoh soal mengenai rumus empiris:
- Berapa rumus empiris dari senyawa dengan komposisi 16% karbon (C), 67% oksigen (O), dan 17% hidrogen (H)?
- Berapa jumlah atom hidrogen (H) dalam satu molekul senyawa dengan rumus empiris H2O?
Rumus Molekul
Rumus molekul menggambarkan jumlah dan jenis atom dalam satu molekul senyawa. Rumus molekul memberikan informasi yang lebih rinci mengenai komposisi atom dalam suatu senyawa dibandingkan rumus empiris. Contohnya, rumus molekul air adalah H2O, yang menunjukkan bahwa dalam setiap molekul air terdapat dua atom hidrogen (H) dan satu atom oksigen (O).
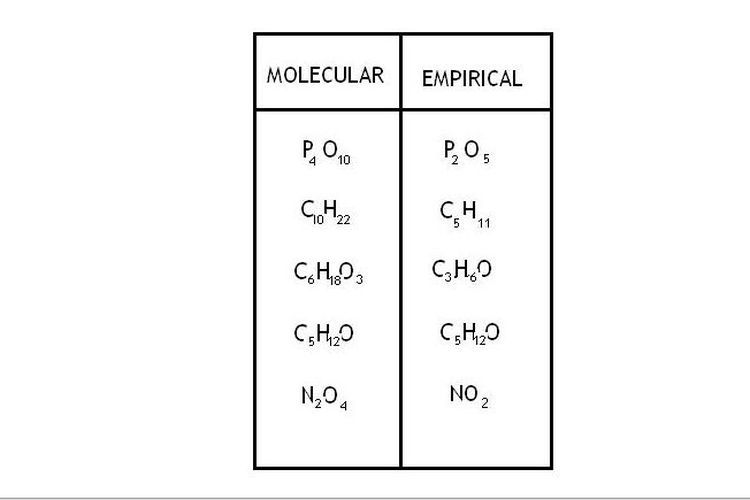
Apa itu rumus molekul? Rumus molekul adalah representasi yang lebih rinci dari susunan atom-atom dalam satu molekul senyawa. Dalam rumus molekul, jumlah dan jenis atom dijelaskan secara spesifik.
Proses menentukan rumus molekul dapat dilakukan dengan langkah-langkah berikut:
- Menentukan rumus empiris dari senyawa.
- Mengukur massa molar senyawa dalam gram/mol.
- Menghitung bilangan molekul dalam satu mol senyawa berdasarkan rumus empiris yang telah ditentukan.
- Mengalikan setiap subskrip dalam rumus empiris dengan bilangan molekul yang dihitung sebelumnya.
Definisi rumus molekul dapat disimpulkan sebagai representasi yang lebih rinci dari jumlah dan jenis atom dalam satu molekul senyawa.
Proses menentukan rumus molekul dapat diilustrasikan melalui contoh berikut:
- Dalam suatu senyawa, rumus empiris adalah CH2O dan massa molar senyawa tersebut adalah 30 gram/mol.
- Menghitung bilangan molekul dalam satu mol berdasarkan rumus empiris yang telah ditemukan.
- Massa molar C = 12 gram/mol
- Massa molar H = 1 gram/mol
- Massa molar O = 16 gram/mol
- Maka, jumlah mol dalam satu mol senyawa = 1 mol (C) + 2 mol (H) + 1 mol (O) = 4 mol
- Setiap subskrip dalam rumus empiris dikalikan dengan bilangan molekul yang dihitung sebelumnya.
- CH2O x 4 = C4H8O4
- Maka, rumus molekul dari senyawa tersebut adalah C4H8O4.
Hasil yang diperoleh dari perhitungan rumus molekul adalah C4H8O4. Rumus molekul memberikan informasi yang lebih spesifik tentang komposisi atom dalam suatu senyawa dibandingkan rumus empiris.
Berikut ini adalah contoh soal mengenai rumus molekul:
- Jika rumus empiris sebuah senyawa adalah CH dan massa molar senyawa tersebut adalah 78 gram/mol, berapa rumus molekulnya?
- Berapa jumlah atom oksigen (O) dalam satu molekul senyawa dengan rumus molekul C6H12O6?
Kesimpulan
Dalam menjelaskan perbedaan antara rumus empiris dan rumus molekul, dapat disimpulkan bahwa:
- Rumus empiris menggambarkan komposisi relatif berat atom-atom dalam suatu senyawa dengan menggunakan bilangan bulat terkecil, sedangkan rumus molekul menggambarkan jumlah dan jenis atom dalam satu molekul senyawa.
- Rumus empiris memberikan informasi mengenai perbandingan atom dalam suatu senyawa, sedangkan rumus molekul memberikan informasi yang lebih rinci tentang komposisi atom dalam suatu senyawa.
- Proses menentukan rumus empiris melibatkan langkah-langkah seperti menentukan massa atau persentase massa atom, mengubah massa atom menjadi mol, membagi setiap bilangan mol dengan bilangan mol terkecil, dan menggandakan rasio bilangan mol dengan bilangan terkecil untuk mendapatkan rumus empiris.
- Proses menentukan rumus molekul melibatkan langkah-langkah seperti menentukan rumus empiris dari senyawa, mengukur massa molar senyawa dalam gram/mol, menghitung bilangan molekul dalam satu mol berdasarkan rumus empiris, dan mengalikan setiap subskrip dalam rumus empiris dengan bilangan molekul yang dihitung sebelumnya untuk mendapatkan rumus molekul.
Dengan memahami perbedaan antara rumus empiris dan rumus molekul, kita dapat memperoleh pemahaman yang lebih mendalam tentang komposisi atom dalam suatu senyawa. Melalui contoh soal yang diberikan, diharapkan kita dapat lebih terlatih dalam menentukan rumus empiris dan rumus molekul dari suatu senyawa.


