Larutan Asam dan Basa: Apa Itu, Cara Kerja, Definisi, Proses, Hasil, Contoh, dan Kesimpulan
Larutan asam dan basa merupakan dua jenis larutan yang sangat penting dalam ilmu kimia. Larutan ini memiliki sifat-sifat khusus yang membuatnya berbeda dengan larutan lainnya. Dalam artikel ini, kita akan membahas apa itu larutan asam dan basa, cara kerjanya, definisi, proses pembentukannya, hasil yang didapatkan, contoh-contohnya, dan kesimpulan.
Larutan Asam
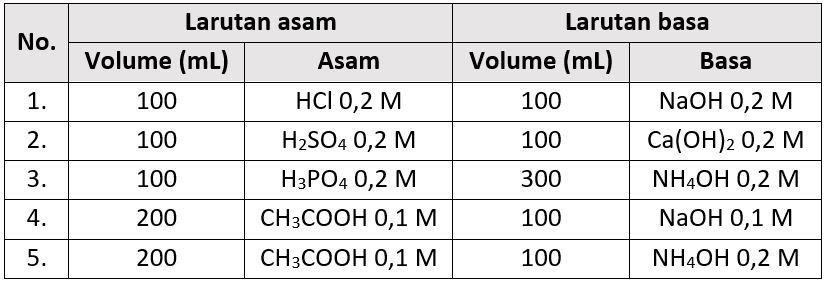
Larutan asam adalah larutan yang memiliki pH kurang dari 7. pH adalah ukuran keasaman atau kebasaan suatu larutan, dimana jika pH kurang dari 7 maka larutan tersebut bersifat asam. Asam dapat membentuk ion hidrogen (H+) ketika larutan tersebut dilarutkan dalam air. Contoh larutan asam adalah larutan HCl (asam klorida) dan H2SO4 (asam sulfat).
Larutan Basa
Larutan basa adalah larutan yang memiliki pH lebih dari 7. Basa dapat membentuk ion hidroksida (OH-) ketika larutan tersebut dilarutkan dalam air. Contoh larutan basa adalah larutan NaOH (natrium hidroksida) dan KOH (kalium hidroksida).
Cara Kerja Larutan Asam dan Basa
Cara kerja larutan asam dan basa terjadi melalui reaksi ionisasi. Pada larutan asam, ionisasi terjadi ketika molekul asam tersebut melepaskan ion hidrogen ke dalam larutan. Misalnya, pada larutan HCl, molekul HCl akan melepaskan ion H+ sehingga membentuk larutan asam. Sedangkan pada larutan basa, ionisasi terjadi ketika molekul basa tersebut melepaskan ion hidroksida ke dalam larutan. Misalnya, pada larutan NaOH, molekul NaOH akan melepaskan ion OH- sehingga membentuk larutan basa.
Definisi Larutan Elektrolit
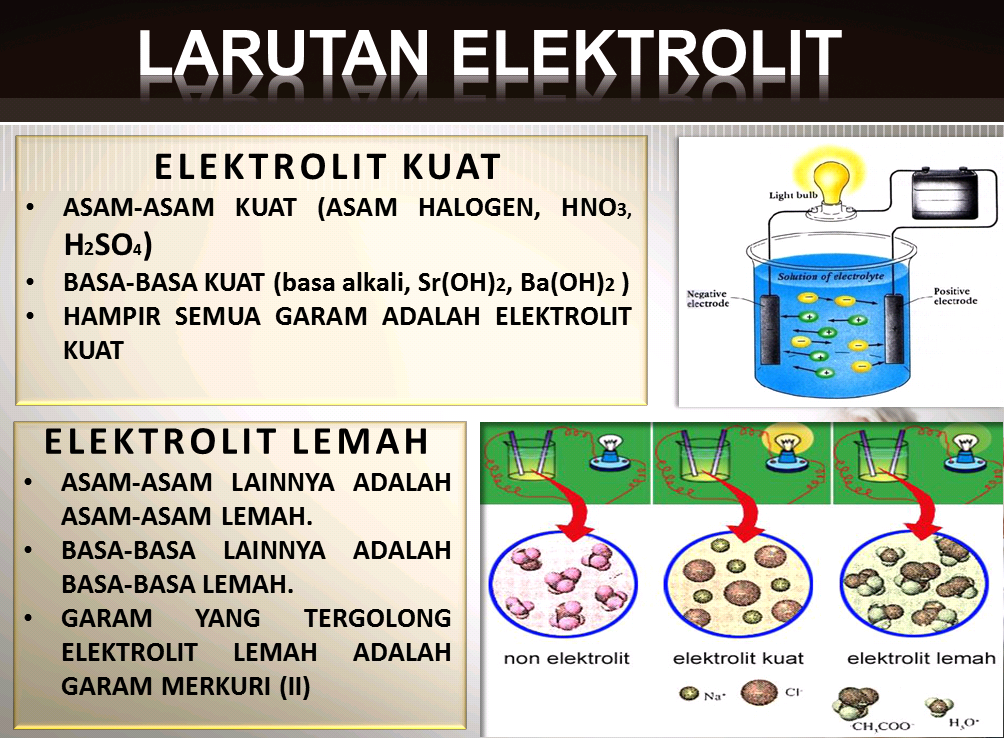
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik. Larutan ini terdiri dari partikel-partikel yang terionisasi atau terdisosiasi menjadi ion-ion ketika larutan tersebut dilarutkan dalam air. Jadi, partikel-partikel dalam larutan elektrolit dapat berpindah muatan dan menghantarkan arus listrik. Contoh larutan elektrolit adalah larutan asam dan basa.
Proses Pembentukan Larutan Elektrolit
Larutan elektrolit terbentuk melalui proses ionisasi atau disosiasi. Ionisasi adalah proses pemisahan molekul menjadi ion-ion ketika larutan tersebut dilarutkan dalam air. Sedangkan disosiasi adalah proses pemisahan ion-ion dalam molekul ketika larutan tersebut dilarutkan dalam air. Misalnya, ketika larutan HCl dilarutkan dalam air, molekul HCl akan membentuk ion H+ dan ion Cl-. Ini merupakan contoh dari proses ionisasi. Sedangkan ketika larutan NaCl dilarutkan dalam air, ion Na+ dan ion Cl- akan terpisah dan bergerak bebas dalam larutan. Ini merupakan contoh dari proses disosiasi.
Hasil Pembentukan Larutan Elektrolit
Hasil pembentukan larutan elektrolit dapat diketahui melalui uji kelarutan. Dalam uji kelarutan, kita dapat melihat apakah suatu senyawa atau zat dapat terionisasi atau terdisosiasi dalam air. Jika senyawa tersebut dapat terionisasi atau terdisosiasi, maka senyawa tersebut dapat membentuk larutan elektrolit. Contoh hasil pembentukan larutan elektrolit adalah larutan asam dan basa. Keberadaan ion-ion dalam larutan elektrolit membuatnya dapat menghantarkan arus listrik dan memiliki sifat konduktor yang baik.
Contoh Larutan Elektrolit
Berikut adalah beberapa contoh larutan elektrolit:
1. Larutan Asam Klorida (HCl)
Larutan HCl adalah salah satu contoh larutan elektrolit yang paling umum. Ketika larutan HCl dilarutkan dalam air, molekul HCl akan terionisasi menjadi ion H+ dan ion Cl-. Kehadiran ion-ion ini membuat larutan HCl dapat menghantarkan arus listrik dan memiliki sifat konduktor yang baik.
2. Larutan Natrium Hidroksida (NaOH)
Larutan NaOH adalah contoh lain dari larutan elektrolit. Ketika larutan NaOH dilarutkan dalam air, molekul NaOH akan terionisasi menjadi ion Na+ dan ion OH-. Kehadiran ion-ion ini membuat larutan NaOH dapat menghantarkan arus listrik dan memiliki sifat konduktor yang baik.
Kesimpulan
Larutan asam dan basa merupakan dua jenis larutan yang memiliki sifat-sifat khusus. Larutan asam memiliki pH kurang dari 7 dan dapat membentuk ion hidrogen ketika dilarutkan dalam air. Larutan basa memiliki pH lebih dari 7 dan dapat membentuk ion hidroksida ketika dilarutkan dalam air. Cara kerja larutan asam dan basa melalui reaksi ionisasi, dimana molekul asam atau basa melepaskan ion hidrogen atau hidroksida ke dalam larutan. Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik dan terbentuk melalui proses ionisasi atau disosiasi. Contoh larutan elektrolit adalah larutan asam dan basa.
Demikianlah penjelasan mengenai larutan asam dan basa. Semoga artikel ini dapat membantu pemahaman Anda tentang topik ini.