Perbedaan Elektron Ikatan dan Elektron Bebas
Apa Itu Elektron Ikatan?
Elektron ikatan adalah elektron yang terlibat dalam pembentukan ikatan kimia antara dua atau lebih atom. Elektron ini berpindah dari satu atom ke atom lain untuk membentuk ikatan yang stabil. Elektron ikatan dikenal juga sebagai elektron valensi, yaitu elektron yang terdapat pada kulit terluar atom yang digunakan untuk membentuk ikatan kimia.
Proses pengikatan elektron ini terjadi melalui pertukaran atau berbagi elektron antara atom-atom dalam suatu molekul. Elektron ikatan dapat membentuk ikatan kovalen, ikatan ionik, atau ikatan kovalen polar tergantung pada jumlah dan sifat elektron ikatan yang terlibat.
Apa Itu Elektron Bebas?
Elektron bebas adalah elektron yang tidak terikat pada atom manapun atau komponen lainnya. Elektron ini tidak terlibat dalam pembentukan ikatan kimia dan dapat bergerak bebas di sekitar dalam suatu struktur seperti logam atau plasma. Elektron bebas memiliki karakteristik yang berbeda dengan elektron ikatan.
Elektron bebas dalam logam memiliki mobilitas tinggi sehingga dapat memberikan konduktivitas listrik yang baik. Sifat ini penting dalam aplikasi teknologi yang menggunakan bahan-bahan konduktor seperti tembaga dan aluminium.
Cara Menentukan Bentuk Molekul Suatu Senyawa
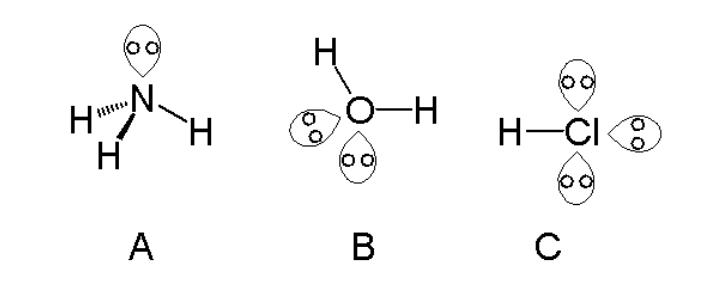
Pada senyawa materi kimia, bentuk molekul menentukan sifat dan reaktivitas senyawa tersebut. Terdapat dua cara utama untuk menentukan bentuk molekul suatu senyawa, yaitu dengan menggunakan teori VSEPR (Valence Shell Electron Pair Repulsion) dan dengan menggunakan data spektroskopi.
Metode VSEPR menggunakan struktur Lewis dari senyawa untuk memprediksi geometri molekul berdasarkan penolakan pasangan elektron di kulit valensi. Metode ini mendasarkan pada asumsi bahwa electron pair di sekitar atom pusat cenderung untuk saling menjauhkan diri sehingga senyawa mencapai tatanama yang paling stabil.
Sedangkan metode spektroskopi menggunakan spektrum elektromagnetik untuk menganalisis interaksi antara materi dan radiasi elektromagnetik. Metode ini memanfaatkan spektrum pemindahan elektron, yaitu perubahan energi elektron ketika berpindah dari satu orbital ke orbital lainnya.
Proses Pembentukan Ikatan Kimia
Proses pembentukan ikatan kimia melibatkan pertukaran atau berbagi elektron antara atom-atom dalam suatu molekul. Terdapat tiga jenis ikatan kimia yang umum terjadi, yaitu ikatan kovalen, ikatan ionik, dan ikatan kovalen polar.
Pada ikatan kovalen, elektron ikatan dibagikan secara bersama-sama oleh dua atom yang terlibat. Elektron ikatan ini terletak di antara dua inti atom yang terhubung dan menjaga atom-atom tetap berdekatan. Bentuk molekul yang dihasilkan oleh ikatan kovalen dapat berupa linear, trigonal planar, tetrahedral, dll.
Sedangkan pada ikatan ionik, terjadi transfer elektron dari satu atom ke atom lainnya. Atom yang menerima elektron menjadi ion negatif (anion), sementara atom yang kehilangan elektron menjadi ion positif (kation). Ikatan ionik biasanya terbentuk antara logam dan nonlogam.
Ikatan kovalen polar adalah kombinasi antara ikatan kovalen dan ikatan ionik. Elektron ikatan dalam ikatan kovalen polar tidak dibagi secara merata, sehingga terdapat perbedaan muatan antara atom-atom yang terikat. Perbedaan muatan ini menciptakan momen dipol yang menyebabkan senyawa memiliki sifat polar.
Hasil dan Contoh Bentuk Molekul
Berdasarkan metode VSEPR dan data spektroskopi, kita dapat menentukan bentuk molekul suatu senyawa. Bentuk molekul ini dapat mempengaruhi sifat dan reaktivitas senyawa tersebut.
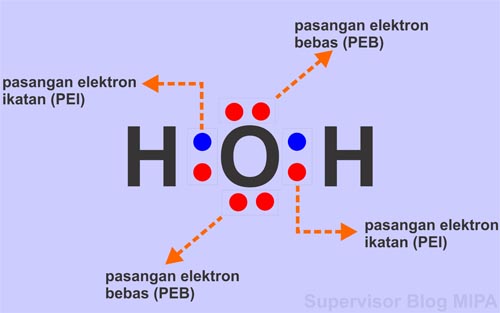
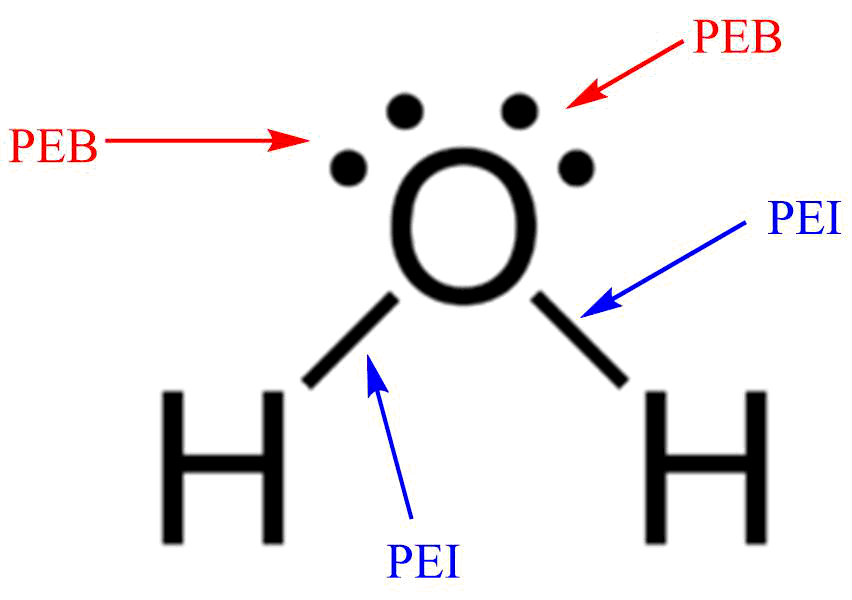
Contoh pertama adalah senyawa H2O (air). Dalam struktur Lewis, oksigen (O) memiliki dua pasangan elektron bebas dan dua elektron ikatan dengan atom hidrogen (H). Berdasarkan metode VSEPR, H2O memiliki bentuk molekul tetrahedral yang dimodifikasi menjadi bentuk molekul angular atau V-shape.
Contoh kedua adalah senyawa CH4 (metana). Dalam struktur Lewis, karbon (C) memiliki empat elektron ikatan dengan empat atom hidrogen (H). Berdasarkan metode VSEPR, CH4 memiliki bentuk molekul tetrahedral dengan sudut ikatan sekitar karbon sebesar 109.5 derajat.
Contoh ketiga adalah senyawa CO2 (karbon dioksida). Dalam struktur Lewis, karbon (C) memiliki dua pasangan elektron bebas dan dua elektron ikatan dengan dua atom oksigen (O). Berdasarkan metode VSEPR, CO2 memiliki bentuk molekul linear dengan sudut ikatan sebesar 180 derajat.
Kesimpulan
Secara kesimpulan, elektron ikatan adalah elektron yang terlibat dalam pembentukan ikatan kimia antara dua atau lebih atom. Elektron ini berperan dalam mempertahankan kestabilan suatu molekul. Sementara itu, elektron bebas adalah elektron yang tidak terikat pada atom manapun dan bergerak bebas dalam struktur tertentu.
Penentuan bentuk molekul suatu senyawa dapat dilakukan dengan menggunakan metode VSEPR yang berdasarkan pada penolakan pasangan elektron di kulit valensi, serta dengan menggunakan data spektroskopi untuk menganalisis interaksi antara materi dan radiasi elektromagnetik.
Proses pembentukan ikatan kimia melibatkan pertukaran atau berbagi elektron antara atom-atom. Ada tiga jenis ikatan kimia utama yaitu kovalen, ionik, dan kovalen polar. Bentuk molekul suatu senyawa dapat mempengaruhi sifat dan reaktivitas senyawa tersebut.
Contoh-contoh bentuk molekul antara lain adalah H2O yang memiliki bentuk molekul angular, CH4 yang memiliki bentuk molekul tetrahedral, dan CO2 yang memiliki bentuk molekul linear.


