Reaksi asam basa adalah salah satu konsep yang penting dalam kimia. Konsep ini mempelajari interaksi antara asam dan basa, serta bagaimana mereka saling berinteraksi dan berhubungan satu sama lain. Dalam artikel ini, kita akan menjelaskan secara detail apa itu reaksi asam basa menurut teori Bronsted Lowry, cara kerjanya, definisi, proses, hasil, contoh, dan kesimpulan.
Reaksi Asam Basa Menurut Bronsted Lowry
Sebelum kita memahami secara lebih dalam mengenai reaksi asam basa menurut teori Bronsted Lowry, penting untuk memiliki pemahaman dasar mengenai apa itu reaksi asam dan basa.
Asam adalah substansi yang mampu melepaskan ion H+ (hidrogen) ketika dilarutkan dalam air. Sedangkan basa adalah substansi yang mampu menerima ion H+ ketika dilarutkan dalam air. Dalam reaksi asam basa tradisional, asam akan melepaskan ion H+ dan basa akan menerima ion H+. Contohnya adalah reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH) yang menghasilkan air (H2O) dan garam (NaCl).
Selain reaksi asam basa tradisional, ada pula teori reaksi asam basa menurut Bronsted Lowry. Menurut teori ini, asam adalah segala zat yang mampu menerima pasangan elektron untuk membentuk ikatan kovalen, sementara basa adalah segala zat yang mampu menyumbangkan pasangan elektron untuk membentuk ikatan kovalen. Dalam reaksi Bronsted Lowry, asam akan berubah menjadi basa konjugasi ketika menerima pasangan elektron, dan sebaliknya, basa akan berubah menjadi asam konjugasi ketika menyumbangkan pasangan elektron.
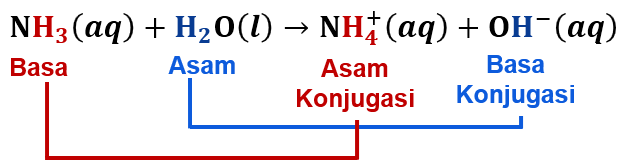
Reaksi asam basa menurut teori Bronsted Lowry sering diilustrasikan dengan contoh ion hidrogen (H+) sebagai asam dan air (H2O) sebagai basa. Dalam reaksi ini, ion hidrogen (H+) berperan sebagai asam dan menerima pasangan elektron dari air (H2O) yang berperan sebagai basa. Akibatnya, air kehilangan pasangan elektron dan berubah menjadi ion hidronium (H3O+). Dalam hal ini, ion hidronium (H3O+) adalah asam konjugasi, sedangkan air (H2O) adalah basa konjugasi.

Apa itu reaksi asam basa konjugasi? Reaksi asam basa konjugasi adalah reaksi antara asam dan basa konjugasi. Asam konjugasi adalah asam yang terbentuk ketika basa menerima pasangan elektron, sedangkan basa konjugasi adalah basa yang terbentuk ketika asam menyumbangkan pasangan elektron.
Cara kerja reaksi asam basa konjugasi sangat mirip dengan cara kerja reaksi asam basa tradisional. Asam konjugasi akan melepaskan ion hidrogen (H+), sedangkan basa konjugasi akan menerima ion hidrogen (H+). Contohnya adalah reaksi antara asam asetat (CH3COOH) dan amonia (NH3) yang menghasilkan asam amonium (NH4+) dan basa asetat (CH3COO-).
Definisi Reaksi Asam Basa Menurut Bronsted Lowry
Seperti yang telah dijelaskan sebelumnya, reaksi asam basa menurut teori Bronsted Lowry adalah reaksi antara asam dan basa, di mana asam menerima pasangan elektron dan menjadi basa konjugasi, sedangkan basa menyumbangkan pasangan elektron dan menjadi asam konjugasi.
Proses reaksi asam basa menurut teori Bronsted Lowry melibatkan transfer pasangan elektron. Asam akan menerima pasangan elektron dari basa, sehingga jumlah elektron dalam asam bertambah. Sebaliknya, basa akan menyumbangkan pasangan elektron ke asam, sehingga jumlah elektron dalam basa berkurang. Dalam hal ini, asam berperan sebagai akseptor elektron dan basa berperan sebagai donor elektron.
Hasil dari reaksi asam basa menurut teori Bronsted Lowry adalah terbentuknya asam konjugasi dan basa konjugasi. Asam konjugasi adalah asam yang terbentuk ketika basa menerima pasangan elektron, sedangkan basa konjugasi adalah basa yang terbentuk ketika asam menyumbangkan pasangan elektron. Dalam reaksi ini, jumlah asam dan basa konjugasi harus seimbang.
Kelemahan Dari Konsep Asam Basa Bronsted Lowry
Meskipun konsep asam basa menurut teori Bronsted Lowry cukup luas digunakan dalam ilmu kimia, namun tetap ada beberapa kelemahan yang perlu diperhatikan. Salah satunya adalah konsep asam basa Bronsted Lowry tidak memperhitungkan kekuatan asam dan basa. Teori ini hanya berkaitan dengan pemindahan pasangan elektron dari satu zat ke zat lain tanpa memperhatikan tingkat keasaman atau kebasaan.
Pada kenyataannya, kekuatan asam dan basa dapat bervariasi. Ada asam yang sangat kuat, seperti asam sulfat (H2SO4) dan asam klorida (HCl), dan ada juga asam yang lemah, seperti asam asetat (CH3COOH). Begitu pula dengan basa, ada basa yang sangat kuat, seperti natrium hidroksida (NaOH), dan ada juga basa yang lemah, seperti amonia (NH3). Dalam teori Bronsted Lowry, tidak dijelaskan mengenai kekuatan asam dan basa ini.
Selain itu, konsep asam basa Bronsted Lowry juga tidak memperhitungkan pengaruh pelarut dalam reaksi. Pelarut dapat mempengaruhi sifat asam dan basa, terutama ketika asam atau basa dalam bentuk larutan. Pelarut dapat mempengaruhi tingkat ionisasi asam atau basa, sehingga mempengaruhi keasaman atau kebasaan zat tersebut.
Meskipun demikian, konsep asam basa Bronsted Lowry masih menjadi dasar dalam memahami reaksi asam basa dalam kehidupan sehari-hari maupun dalam ilmu kimia. Teori ini membantu kita memahami interaksi antara asam dan basa, serta bagaimana mereka saling berhubungan dalam reaksi kimia.
Proses Reaksi Asam Basa Menurut Bronsted Lowry
Proses reaksi asam basa menurut teori Bronsted Lowry melibatkan beberapa tahapan. Tahap pertama adalah tahap pengenalan, di mana asam dan basa yang terlibat dalam reaksi diidentifikasi. Tahap ini penting karena menentukan apakah suatu zat dapat berperan sebagai asam atau basa dalam reaksi.
Tahap kedua adalah tahap pemindahan pasangan elektron. Asam akan menerima pasangan elektron dari basa, sehingga berubah menjadi basa konjugasi. Sebaliknya, basa akan menyumbangkan pasangan elektron ke asam, sehingga berubah menjadi asam konjugasi. Pemindahan pasangan elektron ini terjadi karena adanya gaya tarik elektron antara asam dan basa.
Tahap ketiga adalah tahap pembentukan ikatan kovalen. Setelah terjadi pemindahan pasangan elektron, asam dan basa konjugasi akan membentuk ikatan kovalen. Ikatan ini merupakan hasil dari sharing pasangan elektron antara asam dan basa konjugasi.
Tahap terakhir dalam proses reaksi asam basa menurut teori Bronsted Lowry adalah tahap pembentukan asam konjugasi dan basa konjugasi. Asam konjugasi adalah asam yang terbentuk ketika basa menerima pasangan elektron, sedangkan basa konjugasi adalah basa yang terbentuk ketika asam menyumbangkan pasangan elektron.
Hasil Reaksi Asam Basa Menurut Bronsted Lowry
Hasil dari reaksi asam basa menurut teori Bronsted Lowry adalah terbentuknya asam konjugasi dan basa konjugasi. Asam konjugasi adalah asam yang terbentuk ketika basa menerima pasangan elektron, sedangkan basa konjugasi adalah basa yang terbentuk ketika asam menyumbangkan pasangan elektron.
Asam konjugasi memiliki sifat keasaman yang lebih lemah daripada asam awal, karena telah menerima pasangan elektron. Sebaliknya, basa konjugasi memiliki sifat kebasaan yang lebih lemah daripada basa awal, karena telah menyumbangkan pasangan elektron.
Contoh hasil reaksi asam basa menurut teori Bronsted Lowry adalah reaksi antara asam klorida (HCl) dan natrium hidroksida (NaOH). Dalam reaksi ini, asam klorida bertindak sebagai asam dan ditunjukkan dengan aksioma I (asam) = HCl. Natrium hidroksida bertindak sebagai basa dan ditunjukkan dengan basis III (basa) = NaOH. Hasil dari reaksi ini adalah terbentuknya asam konjugasi (H2O) dan basa konjugasi (NaCl).
Contoh-contoh Reaksi Asam Basa Menurut Bronsted Lowry
Reaksi asam basa menurut teori Bronsted Lowry dapat ditemui dalam kehidupan sehari-hari maupun dalam ilmu kimia. Beberapa contoh-contoh reaksi asam basa menurut teori Bronsted Lowry antara lain:
1. Reaksi antara asam asetat (CH3COOH) dan air (H2O). Dalam reaksi ini, asam asetat bertindak sebagai asam dan air bertindak sebagai basa. Hasil dari reaksi ini adalah terbentuknya asam konjugasi, yaitu ion hidronium (CH3COOH2+), dan basa konjugasi, yaitu ion asetat (CH3COO-). Reaksi ini sangat penting dalam industri kimia, pertanian, dan farmasi.
2. Reaksi antara asam sulfat (H2SO4) dan air (H2O). Dalam reaksi ini, asam sulfat bertindak sebagai asam dan air bertindak sebagai basa. Hasil dari reaksi ini adalah terbentuknya asam konjugasi, yaitu ion hidronium (H3O+), dan basa konjugasi, yaitu ion sulfat (SO4^2-). Reaksi ini sering digunakan dalam percobaan kimia dan dalam pembuatan larutan asam sulfat.
3. Reaksi antara amonia (NH3) dan air (H2O). Dalam reaksi ini, amonia bertindak sebagai basa dan air bertindak sebagai asam. Hasil dari reaksi ini adalah terbentuknya asam konjugasi, yaitu ion hidronium (NH4+), dan basa konjugasi, yaitu ion hidroksida (OH-). Reaksi ini sering terjadi dalam larutan amonia dan dalam proses pengolahan limbah.
Contoh-contoh di atas hanya merupakan beberapa contoh reaksi asam basa menurut teori Bronsted Lowry. Ada banyak reaksi asam basa lainnya yang dapat ditemui dalam kehidupan sehari-hari maupun dalam ilmu kimia. Penting untuk memahami aspek-aspek dasar dari reaksi asam basa Bronsted Lowry agar dapat memahami reaksi asam basa secara lebih luas.
Kesimpulan
Reaksi asam basa menurut teori Bronsted Lowry adalah reaksi antara asam dan basa, di mana asam menerima pasangan elektron dan menjadi basa konjugasi, sedangkan basa menyumbangkan pasangan elektron dan menjadi asam konjugasi. Konsep asam basa Bronsted Lowry merupakan salah satu konsep yang penting dalam kimia dan dapat digunakan untuk memahami reaksi asam basa dalam kehidupan sehari-hari maupun dalam ilmu kimia.
Dalam reaksi asam basa menurut teori Bronsted Lowry, asam konjugasi adalah asam yang terbentuk ketika basa menerima pasangan elektron, sedangkan basa konjugasi adalah basa yang terbentuk ketika asam menyumbangkan pasangan elektron. Asam konjugasi memiliki sifat keasaman yang lebih lemah daripada asam awal, sedangkan basa konjugasi memiliki sifat kebasaan yang lebih lemah daripada basa awal.
Pada prinsipnya, reaksi asam basa menurut teori Bronsted Lowry melibatkan transfer pasangan elektron antara asam dan basa. Asam akan menerima pasangan elektron dari basa, sehingga menjadi basa konjugasi, sedangkan basa akan menyumbangkan pasangan elektron ke asam, sehingga menjadi asam konjugasi. Dalam hal ini, asam berperan sebagai akseptor elektron, sedangkan basa berperan sebagai donor elektron.
Sebagai konsep dasar dalam ilmu kimia, konsep asam basa Bronsted Lowry memiliki beberapa kelemahan, seperti tidak memperhitungkan kekuatan asam dan basa serta tidak memperhitungkan pengaruh pelarut dalam reaksi. Namun demikian, konsep ini masih digunakan luas dalam memahami reaksi asam basa dan merupakan dasar dalam mempelajari konsep asam basa yang lebih kompleks.


