Hukum Proust Atau Hukum Perbandingan Tetap Menyatakan Bahwa

Apa itu Hukum Proust?
Hukum Proust, juga dikenal sebagai Hukum Perbandingan Tetap, adalah prinsip penting dalam bidang kimia yang ditemukan oleh seorang kimiawan Prancis bernama Joseph Louis Proust pada tahun 1799. Hukum ini menyatakan bahwa dalam suatu senyawa kimia, unsur-unsur yang terlibat akan selalu berperbandingan tetap dalam massa. Artinya, jika kita memiliki dua unsur yang membentuk suatu senyawa, maka perbandingan massa kedua unsur tersebut akan selalu sama, tidak peduli berapa jumlah materi yang digunakan. Hukum ini menjadi dasar penting dalam pengembangan ilmu kimia modern.
Siapa Joseph Louis Proust?
Joseph Louis Proust adalah seorang kimiawan Prancis yang lahir pada tanggal 26 September 1754 di Angers, Prancis. Ia dikenal sebagai penemu Hukum Proust (Hukum Perbandingan Tetap) yang menjadi salah satu kontribusi pentingnya dalam ilmu kimia. Selain itu, Proust juga terlibat dalam penelitian lainnya, termasuk penelitian tentang senyawa belerang dan bijih besi.
Kapan Hukum Proust ditemukan?
Hukum Proust ditemukan pada tahun 1799 oleh Joseph Louis Proust. Pada saat itu, Proust sedang melakukan eksperimen untuk mempelajari karakteristik berbagai senyawa kimia. Ia melakukan berbagai percobaan dengan memanaskan senyawa-senyawa tertentu, yang kemudian menghasilkan temuan bahwa perbandingan massa unsur-unsur dalam suatu senyawa cenderung tetap.
Dimana Hukum Proust berlaku?
Hukum Proust berlaku dalam semua senyawa kimia. Prinsip ini berlaku di mana pun ada reaksi kimia antara unsur-unsur yang membentuk senyawa-senyawa tersebut. Hukum ini menjadi dasar bagi percobaan dan penelitian di berbagai bidang ilmu kimia, termasuk sintesis senyawa-senyawa baru, analisis komposisi senyawa kimia, dan banyak lagi.
Bagaimana Hukum Proust bekerja?
Hukum Proust bekerja dengan mengikuti prinsip bahwa massa dalam sistem tertutup selalu konstan. Misalnya, jika kita memiliki dua unsur A dan B yang membentuk suatu senyawa, maka massa A yang bereaksi dengan massa B akan selalu berbanding tetap. Artinya, jika A bereaksi dengan B dalam perbandingan massa tertentu, maka tidak peduli berapa jumlah A dan B yang digunakan, massa tetap akan sama asalkan perbandingannya tetap. Dengan kata lain, tidak ada atom yang hilang atau ditambah selama reaksi kimia berlangsung.
Cara Menggunakan Hukum Proust dalam Praktik
1. Identifikasi unsur-unsur yang terlibat
Dalam suatu senyawa kimia, identifikasi dan catat unsur-unsur yang berpartisipasi dalam reaksi kimia. Misalnya, jika kita ingin mengamati reaksi antara sulfur (S) dan oksigen (O) untuk membentuk senyawa sulfur dioksida (SO2), unsur-unsur yang terlibat adalah sulfur (S) dan oksigen (O).
2. Tentukan perbandingan massa
Tentukan perbandingan massa antara unsur-unsur yang terlibat dalam reaksi kimia tersebut. Gunakan persamaan reaksi kimia dan pengetahuan tentang rumus molekul untuk menghitung perbandingan massa yang tepat.
3. Lakukan percobaan
Siapkan percobaan dengan menggunakan massa yang tepat sesuai dengan perbandingan massa yang telah ditentukan. Pastikan kuantitas materi yang digunakan sesuai dengan perbandingan massa yang sama.
4. Analisis hasil percobaan
Setelah percobaan selesai, analisis dan bandingkan massa hasil percobaan dengan perbandingan massa yang telah ditentukan sebelumnya. Jika massa tetap sesuai dengan perbandingan massa yang diharapkan, maka Hukum Proust dinyatakan benar dalam kasus tersebut.
Kesimpulan
Hukum Proust, juga dikenal sebagai Hukum Perbandingan Tetap, menyatakan bahwa dalam suatu senyawa kimia, unsur-unsur yang terlibat akan selalu berperbandingan tetap dalam massa. Hukum ini ditemukan oleh Joseph Louis Proust pada tahun 1799 dan menjadi dasar penting dalam pengembangan ilmu kimia modern. Hukum Proust berlaku dalam semua senyawa kimia dan digunakan sebagai panduan dalam berbagai percobaan dan penelitian dalam bidang ilmu kimia. Dengan menggunakan Hukum Proust, kita dapat mengidentifikasi unsur-unsur yang terlibat dalam suatu senyawa, menentukan perbandingan massa yang tepat, melakukan percobaan, dan menganalisis hasilnya. Prinsip ini memungkinkan kita untuk memahami reaksi kimia dengan lebih baik dan membantu dalam pengembangan ilmu kimia secara keseluruhan.
Materi Hukum Dasar Kimia Lengkap dengan Contoh – Cergaz.com
Apa itu Hukum Dasar Kimia?
Hukum dasar kimia adalah sejumlah prinsip dan konsep yang mendasari studi tentang materi, sifat-sifatnya, dan reaksi-reaksi yang terjadi di antara unsur-unsur kimia. Hukum dasar kimia membantu kita untuk memahami cara kerja dunia kimia dan menjelaskan fenomena-fenomena alam yang melibatkan materi. Dalam ilmu kimia, kita mengenal banyak hukum dasar yang menjadi pondasi dalam mempelajari berbagai konsep dan teori.
Apa yang Termasuk dalam Materi Hukum Dasar Kimia?
Materi hukum dasar kimia mencakup berbagai konsep dan prinsip penting, antara lain:
1. Hukum Proust (Hukum Perbandingan Tetap): Menyatakan bahwa dalam suatu senyawa kimia, unsur-unsur yang terlibat akan selalu berperbandingan tetap dalam massa.
2. Hukum Dalton (Hukum Proporsi Tetap): Menyatakan bahwa ketika unsur-unsur bereaksi untuk membentuk senyawa, mereka akan selalu berada dalam perbandingan massa yang sederhana.
3. Hukum Avogadro (Hukum Volume Tetap): Menyatakan bahwa gas-gas yang memiliki volume dan tekanan yang sama pada kondisi yang sama juga akan memiliki jumlah partikel yang sama, meskipun berbeda dalam massa.
4. Hukum Gay-Lussac (Hukum Proporsi Gas): Menyatakan bahwa volume sempurna gas yang bereaksi dan volume gas yang dihasilkan berada dalam perbandingan yang sama, bila suhu dan tekanan konstan.
5. Hukum Kekekalan Massa: Menyatakan bahwa massa dalam sistem tertutup tetap konstan selama reaksi kimia, di mana tidak ada atom yang hilang atau ditambah selama reaksi berlangsung.
6. Hukum Kekekalan Energi: Menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan dalam suatu sistem tertutup, tetapi hanya dapat diubah bentuknya.
7. Hukum Stokiomatri: Menyatakan bahwa dalam suatu reaksi kimia, perbandingan antara jumlah partikel yang bereaksi dan jumlah partikel yang dihasilkan akan berada dalam perbandingan bilangan bulat yang sederhana.
8. Hukum Raoult: Menyatakan bahwa tekanan uap suatu pelarut ideal adalah hasil perkalian antara fraksi mol pelarut dalam larutan dengan tekanan uap pelarut murni.
9. Hukum Hooke: Menyatakan bahwa gaya yang timbul pada suatu pegas atau benda elastis berbanding lurus dengan perubahan panjang atau deformasi yang terjadi. Hukum ini juga dikenal sebagai hukum elastisitas materi.
10. Hukum Snellius (Hukum Patahan Cahaya): Menyatakan bahwa ketika cahaya melewati permukaan batas antara dua media transparan, sudut datang akan berbanding terbalik dengan indeks bias kedua media tersebut.
Cara Mempelajari Materi Hukum Dasar Kimia
1. Membaca dan memahami teori
Bacalah teori dan konsep dasar mengenai hukum dasar kimia. Anda dapat menggunakan buku teks kimia atau sumber belajar online untuk mempelajari materi ini. Setelah itu, pastikan Anda memahami dengan baik setiap konsep dan prinsip yang diajarkan.
2. Menggunakan contoh dan latihan
Gunakan contoh-contoh yang telah disediakan atau cari latihan-latihan mengenai hukum dasar kimia untuk menguji pemahaman Anda. Latihan-latihan ini akan membantu Anda dalam mengaplikasikan konsep dan prinsip yang telah dipelajari.
3. Diskusi dan bertanya kepada guru atau teman
Jika ada hal yang kurang jelas atau Anda memiliki pertanyaan mengenai materi hukum dasar kimia, jangan ragu untuk diskusi dengan guru atau teman sekelas. Diskusi ini akan membantu Anda dalam memperdalam pemahaman Anda.
4. Lakukan percobaan dan praktikum
Praktikum kimia adalah salah satu cara terbaik untuk mempelajari hukum dasar kimia secara langsung. Melalui percobaan dan praktikum, Anda akan mengamati dan mengalami sendiri fenomena-fenomena kimia yang melibatkan hukum dasar tersebut.
5. Review dan revisi
Singkirkan kesalahan-kesalahan yang telah Anda lakukan melalui review dan revisi. Setelah Anda merasa cukup memahami, ulangi langkah-langkah sebelumnya untuk memperdalam pemahaman Anda.
Kesimpulan
Hukum dasar kimia adalah prinsip dan konsep yang menjadi pondasi dalam mempelajari ilmu kimia. Materi hukum dasar kimia mencakup berbagai konsep dan prinsip penting seperti Hukum Proust, Hukum Dalton, Hukum Avogadro, Hukum Gay-Lussac, Hukum Kekekalan Massa, Hukum Kekekalan Energi, Hukum Stokiomatri, Hukum Raoult, Hukum Hooke, dan Hukum Snellius. Untuk mempelajari materi hukum dasar kimia, cara yang efektif meliputi membaca dan memahami teori, menggunakan contoh dan melakukan latihan, diskusi dengan guru atau teman, melakukan percobaan dan praktikum, serta melakukan review dan revisi. Dengan memahami dan menguasai hukum dasar kimia, kita dapat lebih memahami fenomena-fenomena kimia di sekitar kita dan menerapkan ilmu kimia dalam berbagai aspek kehidupan sehari-hari.
Contoh Soal Hukum Proust – Homecare24
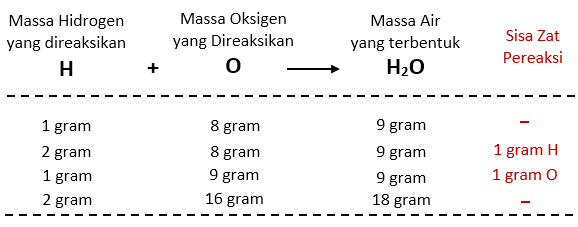
Apa itu Hukum Proust?
Hukum Proust, juga dikenal sebagai Hukum Perbandingan Tetap, adalah prinsip yang menyatakan bahwa dalam suatu senyawa kimia, unsur-unsur yang terlibat akan selalu berperbandingan tetap dalam massa. Artinya, jika kita memiliki dua unsur yang membentuk suatu senyawa, maka perbandingan massa kedua unsur tersebut akan selalu sama, tidak peduli berapa jumlah materi yang digunakan. Hukum ini ditemukan oleh seorang kimiawan Prancis bernama Joseph Louis Proust pada tahun 1799 dan menjadi dasar penting dalam pengembangan ilmu kimia modern.
Contoh Soal Hukum Proust:
1. Berapa massa oksigen yang dibutuhkan untuk bereaksi dengan 2 gram hidrogen untuk membentuk air (H2O)?
A. 16 gram
B. 18 gram
C. 20 gram
D. 22 gram
E. 24 gram
Jawaban: B (18 gram)
Pembahasan:
Berdasarkan Hukum Proust, kita tahu bahwa perbandingan massa hidrogen dan oksigen dalam air adalah 2:16 atau 1:8. Jika massa hidrogen yang digunakan adalah 2 gram, maka massa oksigen yang dibutuhkan adalah 8 x 2 = 16 gram.
2. Berapa massa karbon dioksida (CO2) yang dihasilkan dari pembakaran lengkap 32 gram propana (C3H8)?
A. 32 gram
B. 44 gram
C. 64 gram
D. 88 gram
E. 96 gram
Jawaban: B (44 gram)
Pembahasan:
Propana (C3H8) terdiri dari 3 atom karbon dan 8 atom hidrogen. Dalam


