Dalam dunia fisika, terdapat beberapa hukum termodinamika yang menentukan perilaku suatu sistem dalam hubungannya dengan energi. Hukum-hukum ini menjadi dasar dalam menjelaskan segala fenomena yang terjadi di alam semesta. Dalam artikel ini, kita akan membahas Hukum Termodinamika 1 dan 2 beserta pengertiannya, rumus-rumus yang terkait, contoh soal, serta kesimpulannya.
Hukum Termodinamika 1: Hukum Kekekalan Energi
Hukum Termodinamika 1, juga dikenal sebagai Hukum Kekekalan Energi, menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, melainkan hanya dapat berubah bentuk dari satu bentuk ke bentuk lainnya. Ini adalah konsep dasar dalam ilmu fisika yang juga berlaku dalam termodinamika.
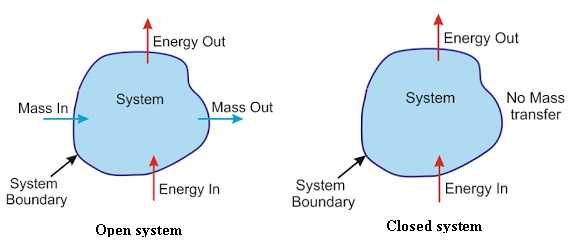
Apa itu Hukum Termodinamika 1? Hukum ini menyatakan bahwa jumlah total energi dalam suatu sistem terisolasi selalu tetap. Energinya dapat berubah dari energi kinetik menjadi energi potensial, energi termal, energi listrik, atau bentuk energi lainnya. Namun, total energi dalam sistem tersebut tidak akan berubah.
Siapa yang menemukan Hukum Termodinamika 1? Konsep kekekalan energi pertama kali diajukan oleh Julius Robert von Mayer pada tahun 1842. Kemudian, Hermann von Helmholtz pada tahun 1847 menambahkan penjelasan yang lebih komprehensif tentang kekekalan energi.
Kapan Hukum Termodinamika 1 ditemukan? Hukum Termodinamika 1 pertama kali ditemukan dan diterbitkan pada abad ke-19 oleh Julius Robert von Mayer dan Hermann von Helmholtz seperti yang telah disebutkan sebelumnya.
Dimana Hukum Termodinamika 1 berlaku? Hukum ini berlaku di semua sistem terisolasi yang tidak mengalami interaksi dengan sistem luar. Dalam sistem seperti itu, energi dapat berubah bentuk, tetapi jumlah total energi tetap sama.
Bagaimana penerapan Hukum Termodinamika 1 dalam kehidupan sehari-hari? Salah satu contoh penerapan hukum ini adalah dalam perubahan energi secara termodinamika pada mesin-mesin. Misalnya, ketika bahan bakar diubah menjadi energi mekanik melalui proses pembakaran di dalam mesin kendaraan, energi tersebut tidak akan diciptakan atau dimusnahkan. Energinya hanya berubah bentuk dari energi kimia dalam bahan bakar menjadi energi mekanik yang digunakan untuk menggerakkan kendaraan.
Hukum Termodinamika 2: Hukum Entropi
Hukum Termodinamika 2, juga dikenal sebagai Hukum Entropi, menyatakan bahwa entropi suatu sistem terisolasi akan selalu meningkat atau setidaknya tetap konstan seiring berjalannya waktu. Entropi merupakan ukuran dari tingkat ketidaturan atau kekacauan suatu sistem.
Apa itu Hukum Termodinamika 2? Hukum ini menyatakan bahwa dalam sistem terisolasi, entropi akan meningkat atau setidaknya tetap konstan. Dengan kata lain, ketika suatu sistem dibiarkan sendiri, kemungkinan kekacauan dalam sistem tersebut akan terus meningkat.
Siapa yang menemukan Hukum Termodinamika 2? Hukum Entropi ini diajukan oleh seorang fisikawan ternama bernama Rudolf Clausius pada tahun 1850.
Kapan Hukum Termodinamika 2 ditemukan? Hukum Termodinamika 2 ditemukan oleh Rudolf Clausius pada tahun 1850.
Dimana Hukum Termodinamika 2 berlaku? Hukum ini berlaku di semua sistem terisolasi yang tidak mengalami interaksi dengan sistem luar. Dalam sistem seperti itu, entropi selalu meningkat atau tetap konstan seiring berjalan waktu.
Bagaimana penerapan Hukum Termodinamika 2 dalam kehidupan sehari-hari? Salah satu contoh penerapan hukum ini adalah dalam proses perubahan wujud air. Ketika air dipanaskan, entropi air akan meningkat. Molekul-molekul air menjadi lebih bergerak, dan wujud air berubah menjadi uap air yang memiliki tingkat ketidaturan yang lebih tinggi dibandingkan dengan wujud air cair atau beku.
Rumus Hukum Termodinamika
Terkait dengan Hukum Termodinamika 1 dan 2, terdapat beberapa rumus yang berkaitan dengan konsep-konsep tersebut. Berikut ini adalah beberapa rumus yang terkait dengan hukum termodinamika:
1. Hukum Termodinamika 1:
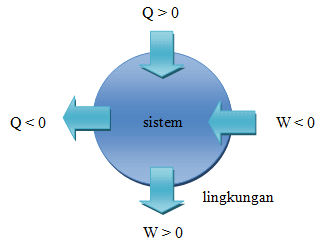
Rumus: ΔU = Q – W
Keterangan:
- ΔU adalah perubahan energi dalam sistem
- Q adalah jumlah panas yang ditambahkan ke sistem
- W adalah kerja yang dilakukan oleh sistem
2. Hukum Termodinamika 2:
Rumus: ΔS ≥ 0
Keterangan:
- ΔS adalah perubahan entropi dalam sistem

Contoh soal Hukum Termodinamika:
- Jika sebuah mesin menerima 500 J energi panas dan melakukan 300 J kerja, berapa perubahan energi dalam sistem? Gunakan rumus Hukum Termodinamika 1.
- Jika entropi suatu sistem tetap konstan, berapakah nilai perubahan energi dalam sistem? Gunakan rumus Hukum Termodinamika 1.
- Jika entropi suatu sistem meningkat sebesar 50 J/K, berapa panas yang ditambahkan ke sistem? Gunakan rumus Hukum Termodinamika 2.
Kesimpulan
Dalam artikel ini, kita telah membahas Hukum Termodinamika 1 dan 2, yaitu Hukum Kekekalan Energi dan Hukum Entropi. Hukum Termodinamika 1 menyatakan bahwa energi tidak dapat diciptakan atau dimusnahkan, melainkan hanya dapat berubah bentuk dari satu bentuk ke bentuk lainnya. Hukum Termodinamika 2 menyatakan bahwa entropi suatu sistem terisolasi akan selalu meningkat atau setidaknya tetap konstan seiring berjalannya waktu.
Rumus-rumus terkait dengan hukum termodinamika, seperti rumus Hukum Termodinamika 1 dan rumus Hukum Termodinamika 2, juga telah dibahas dalam artikel ini. Rumus-rumus ini dapat digunakan untuk menghitung perubahan energi dan entropi dalam suatu sistem.
Dengan pemahaman yang baik tentang hukum-hukum termodinamika dan rumus-rumus yang terkait, kita dapat lebih memahami fenomena-fenomena alam yang terkait dengan energi dan entropi. Hukum-hukum ini memiliki aplikasi yang luas dalam berbagai bidang, termasuk dalam mekanika, fisika bahan, termal, atau bahkan dalam pengembangan teknologi.
Semoga artikel ini dapat memberikan pemahaman yang lebih baik tentang Hukum Termodinamika 1 dan 2 kepada pembaca. Dengan pemahaman yang baik tentang hukum-hukum ini, kita dapat lebih menghargai dan memahami bagaimana energi berperan dalam kehidupan kita sehari-hari.


