Halo semuanya! Kali ini kita akan membahas mengenai Massa Atom Relatif dan Molekul Relatif. Apa sih Massa Atom Relatif dan Molekul Relatif itu? Yuk kita bahas!
Menentukan Massa Atom Relatif dan Molekul Relatif
Masa Atom Relatif (Ar) adalah rasio berat atom unsur terhadap 1\/12 dari berat atom C-12 yang dikalikan 100. Cara menghitungnya adalah:

Masa Molekul Relatif (Mr) adalah rasio berat molekul senyawa terhadap 1\/12 berat atom C-12 yang dikalikan 100. Cara menghitungnya adalah:
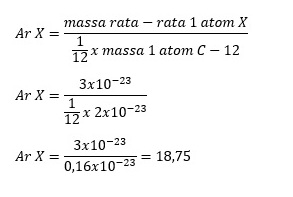
Contoh Soal Massa Atom dan Molekul Relatif
Nah, sekarang kita akan coba mempraktekkan cara menghitung massa atom relatif dan molekul relatif dengan beberapa contoh soal!
Contoh Soal 1
Hitunglah massa atom relatif dari unsur N. Berat atom unsur N adalah 14u.
Jawaban:
Ar N = (14\/12) x 100% = 116.67%
Contoh Soal 2
Tentukanlah massa molekul relatif senyawa CO2
Jawaban:
Mr CO2 = ((12.01 + (2 x 16.00)) \/ 12) x 100% = 44.01%
Cara Menghitung Massa Atom dan Molekul Relatif
Nah, sekarang kita akan bahas cara menghitung massa atom dan molekul relatif lebih detail.
Cara Menghitung Massa Atom Relatif
Berikut adalah rumus cara menghitung massa atom relatif:

Keterangan:
- Ar = Massa Atom Relatif
- A = Massa Atom suatu unsur
- u = satuan massa (1u = 1\/12 massa dari atom C-12)
Cara Menghitung Massa Molekul Relatif
Berikut adalah rumus cara menghitung massa molekul relatif:

Keterangan:
- Mr = Massa Molekul Relatif
- σ = jumlah semua massa atom dalam satu molekul senyawa (dalam satuan u)
- u = satuan massa (1u = 1\/12 massa dari atom C-12)
Contoh Soal Menghitung Massa Atom dan Molekul Relatif
Coba sekarang kita praktekkan cara menghitung massa atom dan molekul relatif dengan beberapa contoh soal yang lebih kompleks. Yuk, dibahas satu per satu!
Contoh Soal 1
Hitung massa molekul relatif dari senyawa asam sulfat (H2SO4)
Jawaban:
γ(H2SO4) = (2 x 1.01) + 32.06 + (4 x 16.00) = 98.08 u
Selanjutnya, kita menghitung massa molekul relatif:
Mr H2SO4 = (98.08 \/ 12) x 100% = 8.17%
Contoh Soal 2
Hitunglah berat besi dalam 3,2 g besi (III) oksida (Fe2O3)
Jawaban:
γ(Fe2O3) = (2 x 55.85) + (3 x 16.00) = 159.70 u
Untuk mengetahui berat besi dalam senyawa tersebut, kita harus menghitung massa molekul relatif. Berikut rumusnya:
Mr Fe2O3 = (159.70 \/ 12) x 100% = 13.31%
Dari sini kita bisa menghitung jumlah besi dalam 3,2 g besi (III) oksida, yaitu:
Berat besi = jumlah molekul Fe2O3 x jumlah atom besi x massa atom besi
Jumlah molekul Fe2O3 = 3.2 g \/ 159.70 g/molekul = 0.02 molekul
Jumlah atom besi = jumlah molekul Fe2O3 x jumlah atom besi dalam molekul Fe2O3
Jumlah atom besi dalam molekul Fe2O3 = 2 atom Fe
Jumlah atom besi = 0.02 x 2 = 0.04 molekul
Berat atom besi = 55.85 u
Berat besi = 0.04 x 55.85 = 2.23 g
Kesimpulan
Demikianlah pembahasan mengenai Massa Atom Relatif dan Molekul Relatif dan cara menghitungnya. Semoga bisa membantu kalian dalam memahami konsep ini!





