Ikatan Ion dan Ikatan Kovalen: Perbedaan dan Contohnya
Pada bidang kimia, terdapat berbagai ikatan kimia yang menghubungkan atom-atom dalam suatu senyawa. Dua jenis ikatan paling umum yang sering kita dengar adalah ikatan ion dan ikatan kovalen. Dalam artikel ini, kita akan membahas pengertian, perbedaan, serta contoh-contoh ikatan ion dan ikatan kovalen.
Ikatan Ion
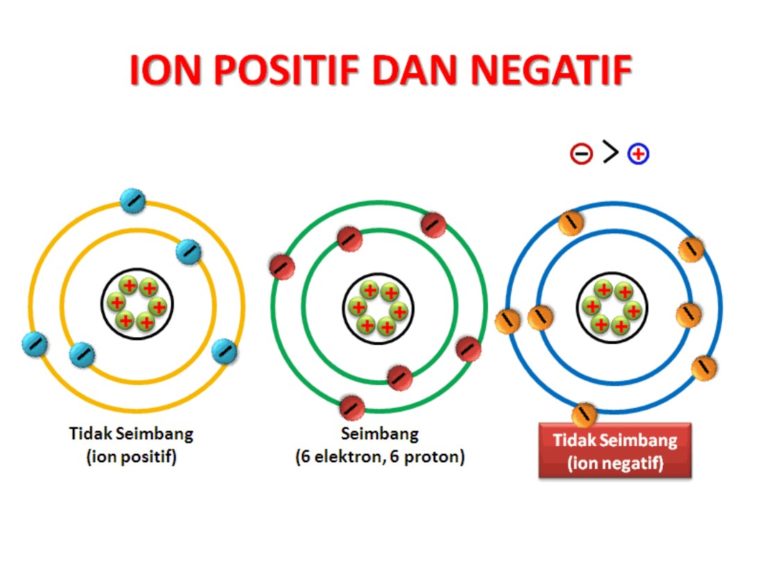
Ikatan ion terjadi ketika atom-atom saling mentransfer elektron. Atom yang menerima elektron akan membentuk ion negatif (anion), sementara atom yang kehilangan elektron akan membentuk ion positif (kation). Ikatan ion biasanya terbentuk antara logam dengan non-logam.
Pengertian Ikatan Ion
Ikatan ion dapat didefinisikan sebagai ikatan kimia antara dua atom yang terjadi melalui transfer elektron, di mana satu atom melepaskan elektron dan atom lainnya menerimanya. Hal ini mengakibatkan terbentuknya dua ion dengan muatan yang berlawanan, yang saling tertarik dan membentuk ikatan.
Perbedaan Ikatan Ion dan Ikatan Kovalen
Perbedaan utama antara ikatan ion dan ikatan kovalen terletak pada cara atom-atom saling berinteraksi dalam membentuk ikatan. Pada ikatan ion, terjadi transfer elektron dimana satu atom kehilangan elektron dan atom lainnya menerima elektron. Sementara itu, pada ikatan kovalen, elektron-elektron dibagi secara bersama-sama oleh atom-atom yang terlibat.
Contoh-contoh Ikatan Ion
1. Natrium Klorida (NaCl)
Ikatan ion paling umum yang sering kita jumpai adalah natrium klorida (NaCl). Dalam ikatan ini, atom natrium (Na) kehilangan satu elektron dan membentuk kation Na+, sedangkan atom klorin (Cl) menerima elektron tersebut dan membentuk anion Cl-. Kation Na+ dan anion Cl- saling tertarik dan membentuk kristal berupa garam dapur.
2. Kalsium Oksida (CaO)
Selain natrium klorida, contoh lain dari ikatan ion adalah kalsium oksida (CaO). Dalam ikatan ini, atom kalsium (Ca) melepaskan dua elektron sehingga membentuk kation Ca2+, sedangkan atom oksigen (O) menerima dua elektron tersebut dan membentuk anion O2-. Kation Ca2+ dan anion O2- saling tertarik dan membentuk senyawa kalsium oksida yang padat.
Ikatan Kovalen
Sebaliknya, ikatan kovalen terjadi ketika dua atom saling berbagi elektron untuk mencapai konfigurasi elektron gas mulia. Dua atom yang saling berbagi elektron disebut pasangan elektron terikat atau pasangan ikatan. Ikatan kovalen umumnya terbentuk antara dua unsur non-logam.
Pengertian Ikatan Kovalen
Ikatan kovalen dapat didefinisikan sebagai ikatan kimia antara dua atom yang terjadi melalui pembagian elektron secara bersama-sama. Dalam ikatan kovalen, elektron-elektron yang terlibat dalam ikatan dipakai bersama oleh atom-atom yang terlibat.
Perbedaan Ikatan Kovalen dan Ikatan Ion
Perbedaan utama antara ikatan kovalen dan ikatan ion terletak pada cara atom-atom saling berinteraksi dalam membentuk ikatan. Pada ikatan kovalen, terjadi pembagian elektron secara bersama-sama antara atom-atom yang terlibat, sedangkan pada ikatan ion terjadi transfer elektron dari satu atom ke atom lain.
Contoh-contoh Ikatan Kovalen
1. Molekul Air (H2O)
Molekul air (H2O) merupakan contoh ikatan kovalen yang paling umum. Dalam molekul ini, atom hidrogen (H) dan atom oksigen (O) saling berbagi elektron untuk mencapai konfigurasi gas mulia. Masing-masing atom hidrogen berbagi satu pasang elektron dengan atom oksigen, sehingga terdapat dua pasang elektron ikatan dalam molekul air.
2. Asam Klorida (HCl)
Contoh lain dari ikatan kovalen adalah asam klorida (HCl). Dalam molekul ini, atom hidrogen (H) dan atom klorin (Cl) saling berbagi elektron sehingga mencapai konfigurasi elektron gas mulia. Masing-masing atom hidrogen berbagi satu pasang elektron dengan atom klorin, membentuk ikatan kovalen tunggal.
Apa Itu Ikatan Ion?
Ikatan ion adalah ikatan kimia yang tercipta melalui transfer elektron antara dua atom. Dalam ikatan ini, satu atom melepaskan elektron dan membentuk ion positif, sedangkan atom lainnya menerima elektron dan membentuk ion negatif.
Mengapa Terjadi Ikatan Ion?
Ikatan ion terjadi karena adanya perbedaan elektronegativitas antara atom-atom yang terlibat. Elektronegativitas adalah kemampuan suatu atom menarik elektron dalam sebuah ikatan kimia. Ketika perbedaan elektronegativitas antara dua atom sangat besar, maka atom dengan elektronegativitas lebih tinggi akan merebut elektron dari atom dengan elektronegativitas lebih rendah.
Ikatan ion terbentuk juga karena adanya kestabilan elektronik. Atom-atom cenderung membentuk ikatan ion jika dengan melepaskan atau menerima elektron, mereka dapat mencapai konfigurasi elektron gas mulia yang stabil. Konfigurasi elektron gas mulia adalah konfigurasi elektron yang mirip dengan konfigurasi elektron atom gas mulia yang memiliki kestabilan tinggi.
Cara Terbentuk Ikatan Ion
Ikatan ion terbentuk melalui beberapa langkah sebagai berikut:
- Pada awalnya, atom-atom yang terlibat dalam ikatan ion memiliki jumlah elektron yang sama dengan nomor atom mereka.
- Atom dengan elektronegativitas lebih tinggi akan menarik elektron dari atom dengan elektronegativitas lebih rendah.
- Atom dengan elektronegativitas lebih rendah kehilangan elektron dan membentuk kation, sedangkan atom dengan elektronegativitas lebih tinggi menerima elektron dan membentuk anion.
- Kation dan anion yang terbentuk saling tertarik satu sama lain melalui gaya elektrostatik, membentuk ikatan ion.
Biaya Terbentuk Ikatan Ion
Tidak ada biaya yang diperlukan dalam pembentukan ikatan ion. Proses pembentukan ikatan ion terjadi secara spontan dan biasanya melibatkan perbedaan elektronegativitas antara atom-atom yang terlibat. Ketika atom-atom saling transfer elektron, energi yang dihasilkan dari pelepasan elektron dari satu atom dan energi yang dibutuhkan untuk menerima elektron oleh atom lain saling menetralkan sehingga tidak ada energi yang diperlukan atau dikeluarkan dalam pembentukan ikatan ion.
Jurusan yang Mempelajari Ikatan Kimia
Berbagai jurusan dalam bidang ilmu kimia mempelajari ikatan kimia, baik dalam tingkat yang lebih dasar maupun lebih kompleks. Berikut adalah beberapa jurusan yang mempelajari ikatan kimia:
1. Kimia
Jurusan kimia adalah jurusan yang secara khusus mempelajari ilmu kimia secara menyeluruh. Matakuliah yang terdapat dalam jurusan kimia meliputi ilmu fisika, kimia organik, kimia anorganik, kimia analitik, serta ikatan dan reaktivitas kimia.
2. Teknik Kimia
Jurusan teknik kimia mempelajari penerapan ilmu kimia dalam bidang teknik dan industri. Mahasiswa pada jurusan ini akan mempelajari ilmu kimia dan teknik dasar, serta menerapkan pengetahuan tersebut dalam merancang dan mengoptimalkan proses-proses kimia dalam industri.
3. Farmasi
Jurusan farmasi mempelajari tentang ilmu farmasi, termasuk obat-obatan dan senyawa-senyawa kimia yang digunakan dalam pengobatan. Mahasiswa pada jurusan ini akan mempelajari ikatan kimia dalam konteks pengembangan dan formulasi obat, serta interaksi obat dengan tubuh manusia.
4. Biologi
Jurusan biologi mempelajari tentang ilmu kehidupan, termasuk kimia hayati. Mahasiswa pada jurusan ini akan mempelajari ikatan kimia dalam konteks interaksi biomolekul dan reaksi kimia yang terjadi di dalam organisme.
5. Fisika
Jurusan fisika mempelajari tentang sifat-sifat materi dan fenomena-fenomena fisika. Mahasiswa pada jurusan ini akan mempelajari ikatan kimia dalam konteks sifat-sifat elektronik dan interaksi partikel-partikel subatomik yang terjadi dalam materi.
Selain jurusan-jurusan di atas, ikatan kimia juga dipelajari dalam berbagai jurusan sains dan teknologi lainnya seperti biokimia, nanoteknologi, dan teknik material. Pengertian dan pemahaman yang mendalam tentang ikatan kimia sangat penting dalam pemahaman tentang sifat-sifat materi dan reaksi kimia.
Kesimpulan
Pada dasarnya, ikatan kimia merupakan interaksi antara atom-atom yang terjadi melalui pembagian atau transfer elektron. Dalam ikatan ion, terjadi transfer elektron sehingga atom-atom membentuk ion-ion dengan muatan berlawanan yang saling tertarik membentuk ikatan. Sementara dalam ikatan kovalen, terjadi pembagian elektron secara bersama-sama sehingga masing-masing atom berbagi elektron dengan atom lainnya.
Contoh-contoh ikatan ion antara lain natrium klorida (NaCl) dan kalsium oksida (CaO). Contoh-contoh ikatan kovalen antara lain molekul air (H2O) dan asam klorida (HCl). Perbedaan utama antara ikatan ion dan ikatan kovalen terletak pada cara atom-atom saling berinteraksi dalam membentuk ikatan.
Jika Anda tertarik mempelajari lebih lanjut tentang ikatan kimia, terdapat berbagai jurusan yang mempelajarinya seperti kimia, teknik kimia, farmasi, biologi, dan fisika.