Konsep Mol pada Perhitungan Kimia
Pada pembelajaran kimia, terdapat berbagai konsep yang penting untuk dipahami, salah satunya adalah konsep mol. Konsep mol adalah konsep dasar dalam kimia yang berkaitan dengan jumlah partikel (atom, molekul, atau ion) dalam suatu zat. Dalam artikel ini, kita akan membahas apa itu konsep mol, mengapa konsep ini penting dalam kimia, cara menghitungnya, biaya studi di jurusan kimia, dan informasi terkait lainnya.
Gambar 1: Konsep Mol pada Perhitungan Kimia
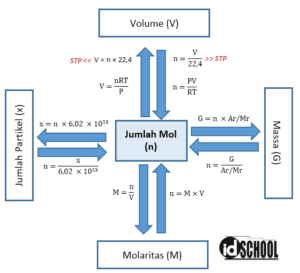
Apa Itu Konsep Mol?
Sebelum kita membahas lebih lanjut tentang konsep mol, kita perlu memahami apa itu mol. Mol adalah satuan dasar yang digunakan dalam kimia untuk mengukur jumlah partikel dalam suatu zat. Satu mol suatu zat mengandung sekitar 6,022 × 10^23 partikel, yang disebut sebagai nomor Avogadro.
Konsep mol digunakan untuk menghubungkan antara massa suatu zat dengan jumlah partikelnya. Dengan menggunakan konsep ini, kita dapat menghitung jumlah partikel dalam suatu zat berdasarkan massa yang diberikan. Konsep mol juga digunakan dalam perhitungan stoikiometri, yaitu perhitungan berdasarkan perbandingan molekul dalam suatu reaksi kimia.
Contoh penggunaan konsep mol adalah saat menghitung jumlah atom atau molekul dalam suatu senyawa. Dalam senyawa air (H2O), terdapat 2 atom hidrogen dan 1 atom oksigen. Jika kita memiliki 2 mol air, maka jumlah total atom hidrogen adalah 2 × 2 × 6,022 × 10^23 = 2 × 1,2044 × 10^24 atom hidrogen.
Gambar 2: Pengertian Konsep Mol dalam Kimia
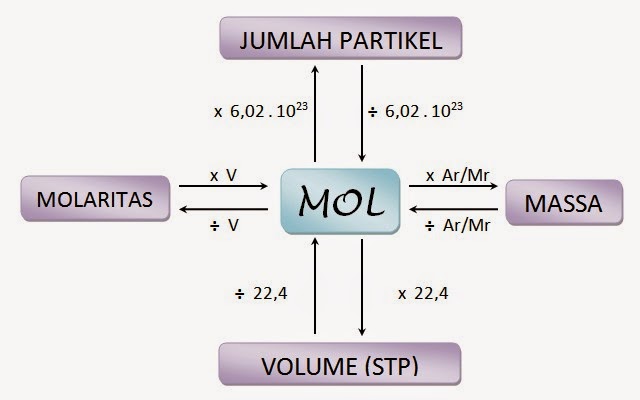
Mengapa Konsep Mol Penting dalam Kimia?
Konsep mol penting dalam kimia karena membantu kita memahami hubungan antara massa dan jumlah partikel dalam suatu zat. Dengan memahami konsep ini, kita dapat menghitung jumlah partikel dalam suatu reaksi kimia, menginterpretasikan hasil percobaan, dan memprediksi reaksi kimia yang mungkin terjadi.
Salah satu contoh penggunaan konsep mol dalam kehidupan sehari-hari adalah dalam pembuatan roti. Dalam resep, terdapat perbandingan antara jumlah tepung, ragi, gula, dan bahan lainnya. Dengan menggunakan konsep mol, kita dapat menghitung berapa banyak ragi yang perlu ditambahkan untuk menghasilkan roti yang sesuai dengan resep.
Selain itu, konsep mol juga penting dalam pembelajaran kimia karena memberikan dasar yang kuat dalam memahami reaksi kimia dan pemodelan molekul. Dengan memahami jumlah partikel dalam suatu zat, kita bisa memprediksi hasil reaksi, memahami sifat-sifat zat, dan merancang molekul baru dengan sifat yang diinginkan.
Gambar 3: Konsep Mol Dan Stoikiometri
Cara Menghitung Konsep Mol
Menghitung konsep mol melibatkan beberapa langkah yang perlu diikuti. Berikut adalah cara menghitung konsep mol:
- Tentukan massa zat yang diberikan. Misalnya, kita memiliki 10 gram air (H2O).
- Hitung jumlah mol dengan menggunakan massa molar zat tersebut. Massa molar air (H2O) adalah 18 gram/mol. Jadi, 10 gram air (H2O) setara dengan 10/18 = 0,556 mol air (H2O).
- Tentukan jumlah partikel dalam satu mol zat. Untuk air (H2O), satu mol mengandung 2 mol hidrogen (H) dan 1 mol oksigen (O). Jadi, 0,556 mol air (H2O) mengandung 0,556 × 2 = 1,112 mol hidrogen (H) dan 0,556 mol oksigen (O).
- Hitung jumlah partikel tertentu dalam zat tersebut. Misalnya, untuk menghitung jumlah atom hidrogen (H), kita bisa menggunakan faktor Avogadro (6,022 × 10^23 atom/mol). Jadi, 1,112 mol hidrogen (H) setara dengan 1,112 × 6,022 × 10^23 = 6,698 × 10^23 atom hidrogen (H).
Dengan mengikuti langkah-langkah di atas, kita dapat menghitung jumlah partikel dalam suatu zat menggunakan konsep mol. Penting untuk diingat bahwa langkah-langkah di atas hanya merupakan contoh umum, dan cara menghitungnya bisa bervariasi tergantung pada jenis zat yang digunakan.
Gambar 4: Contoh Soal Konsep Mol (1)

Biaya Studi di Jurusan Kimia
Jurusan kimia adalah salah satu jurusan yang menarik bagi banyak orang yang tertarik dalam ilmu pengetahuan alam. Biaya studi di jurusan kimia bervariasi tergantung pada universitas dan negara tempat kamu kuliah. Di Indonesia, biaya studi di jurusan kimia di perguruan tinggi negeri lebih terjangkau dibandingkan dengan perguruan tinggi swasta.
Untuk biaya studi di perguruan tinggi negeri, terdapat biaya pendaftaran, Sumbangan Pengembangan Pendidikan (SPP), dan biaya lainnya. Biaya pendaftaran biasanya berkisar antara beberapa ratus ribu rupiah hingga beberapa juta rupiah, tergantung pada universitas dan program studinya.
Sementara itu, SPP untuk jurusan kimia di perguruan tinggi negeri biasanya berkisar antara beberapa juta rupiah hingga puluhan juta rupiah per semester. Besarannya tergantung pada universitas dan program studinya.
Di sisi lain, biaya studi di perguruan tinggi swasta cenderung lebih mahal dibandingkan dengan perguruan tinggi negeri. Biaya pendaftarannya biasanya lebih tinggi, dan SPP-nya pun bisa mencapai puluhan juta rupiah per semester.
Untuk mendukung biaya studi di jurusan kimia, terdapat beberapa beasiswa yang bisa kamu peroleh. Beasiswa dapat diberikan berdasarkan prestasi akademik, prestasi non-akademik, atau kebutuhan finansial. Pastikan untuk mencari informasi tentang beasiswa yang tersedia dan memenuhi syarat-syaratnya.
Demikianlah artikel tentang konsep mol pada perhitungan kimia. Konsep mol penting dalam kimia karena membantu kita memahami hubungan antara massa dan jumlah partikel dalam suatu zat. Untuk menghitung konsep mol, kita perlu mengikuti beberapa langkah yang telah dijelaskan di atas. Selain itu, biaya studi di jurusan kimia bervariasi tergantung pada universitas dan negara tempat kamu kuliah.


