Kesetimbangan Kimia – Konsep, Jenis, Pergeseran, Tetapan dan Aplikasi
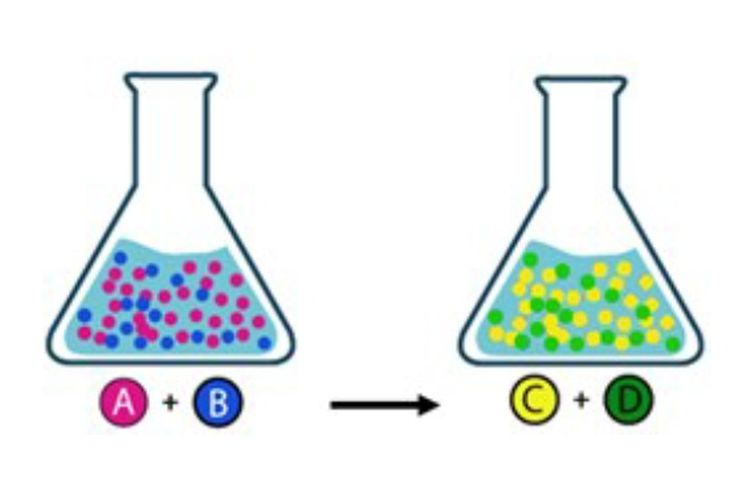
Kesetimbangan kimia adalah salah satu konsep penting dalam dunia ilmu kimia. Saat dua atau lebih zat bereaksi untuk membentuk produk baru, kesetimbangan kimia terjadi ketika laju reaksi maju sama dengan laju reaksi mundur. Dalam kesetimbangan kimia, terdapat keadaan di mana reaksi berjalan ke arah maju dan mundur dengan laju yang sama. Pada titik ini, tidak ada perubahan yang dapat diamati dalam konsentrasi reaktan dan produk.
Ada beberapa jenis kesetimbangan kimia yang biasa ditemui dalam ilmu kimia. Pertama, ada kesetimbangan dinamis, di mana reaksi maju dan mundur terjadi secara bersamaan dengan laju yang sama. Kedua, ada kesetimbangan statis, di mana reaksi hanya berjalan ke arah maju atau mundur sehingga tidak ada perubahan yang dapat diamati.
Kesetimbangan kimia dapat digambarkan dengan menggunakan persamaan reaksi. Misalnya, dalam reaksi pembentukan air dari hidrogen dan oksigen, persamaan reaksinya adalah sebagai berikut:
2H2 + O2 <=> 2H2O
Pada kesetimbangan, jumlah molekul hidrogen dan oksigen di sisi kanan reaksi (produk) akan sama dengan jumlah molekul hidrogen dan oksigen di sisi kiri reaksi (reaktan). Dalam reaksi ini, pada suhu dan tekanan tertentu, laju reaksi pembentukan air akan sama dengan laju reaksi pemecahan air menjadi hidrogen dan oksigen.
Menghitung Reaksi Kesetimbangan Tetapan Kp
Ketika terjadi kesetimbangan kimia, tetapan Kp (konstanta kesetimbangan tekanan) dapat digunakan untuk menghitung konsentrasi zat di kesetimbangan. Tetapan Kp merupakan hasil bagi antara konsentrasi produk pada suatu kesetimbangan dengan konsentrasi reaktan pada kesetimbangan yang sama, di mana konsentrasi dinyatakan dengan tekanan parsial (tekanan yang dihasilkan oleh masing-masing komponen dalam campuran gas).
Untuk menghitung tetapan Kp, kita perlu mengetahui persamaan reaksi kimia yang terlibat dalam kesetimbangan, serta tekanan parsial masing-masing komponen pada kesetimbangan tersebut. Misalnya, dalam reaksi pembentukan amonia dari nitrogen dan hidrogen, persamaan reaksinya adalah sebagai berikut:
N2 + 3H2 <=> 2NH3
Setelah mengetahui persamaan reaksi, kita juga perlu mengetahui tekanan parsial nitrogen, hidrogen, dan amonia pada kesetimbangan. Dalam kasus ini, tekanan parsial ditentukan oleh jumlah mol tiap komponen dan volume wadah reaksi.
Pengertian Kesetimbangan Kimia | Ilmu Kimia

Kesetimbangan kimia adalah kondisi di mana laju reaksi maju sama dengan laju reaksi mundur, sehingga tidak ada perubahan yang dapat diamati dalam konsentrasi reaktan dan produk. Dalam kesetimbangan kimia, konsentrasi zat-zat yang terlibat dalam reaksi tetap konstan seiring dengan berjalannya waktu. Kesetimbangan kimia merupakan konsep dasar yang penting dalam ilmu kimia karena membantu menjelaskan berbagai fenomena kimia yang terjadi di alam.
Dalam kesetimbangan kimia, terdapat beberapa hal yang perlu dipahami, seperti konsep reaktan, produk, laju reaksi, dan tetapan kesetimbangan. Reaktan adalah zat-zat yang bereaksi membentuk produk, sedangkan produk adalah zat-zat yang dihasilkan dari reaksi tersebut. Laju reaksi adalah kecepatan dengan which reaksi berlangsung, sedangkan tetapan kesetimbangan merupakan konstanta yang menggambarkan kecenderungan suatu kesetimbangan untuk bergerak ke arah reaksi maju atau reaksi mundur.
Pengertian dan Contoh Soal Kesetimbangan Kimia Beserta Penjelasan

Kesetimbangan kimia adalah keadaan di mana laju reaksi maju sama dengan laju reaksi mundur, sehingga tidak ada perubahan yang dapat diamati dalam konsentrasi reaktan dan produk. Kesetimbangan kimia banyak ditemui dalam kehidupan sehari-hari. Salah satu contohnya adalah reaksi pembentukan air.
Contoh soal kesetimbangan kimia:
1. Dalam suatu percobaan, 0,2 mol hidrogen direaksikan dengan 0,1 mol nitrogen dalam sebuah wadah tertutup. Pada kesetimbangan, diperoleh 0,15 mol amonia. Berapa tetapan kesetimbangan Kp pada suhu tertentu?
Penyelesaian:
Perhatikan persamaan reaksi: N2 + 3H2 <=> 2NH3
Jumlah mol awal nitrogen (N2) adalah 0,1 mol
Jumlah mol awal hidrogen (H2) adalah 0,2 mol
Jumlah mol awal amonia (NH3) adalah 0 mol
Pada kesetimbangan, diketahui jumlah mol amonia (NH3) adalah 0,15 mol
Substitusikan nilai-nilai tersebut ke dalam persamaan tetapan Kp:
Kp = (0,15)2 / (0,1)(0,2)3
Kp = 0,0225 / 0,004
Kp = 5,625 mol-1
Jadi, tetapan kesetimbangan Kp pada suhu tersebut adalah 5,625 mol-1.


