Jari-jari atom dan energi ionisasi adalah dua konsep yang penting dalam ilmu kimia. Dalam artikel ini, kita akan membahas apa itu jari-jari atom, apa itu energi ionisasi, serta manfaat dan keterbatasan dari konsep-konsep ini. Kita juga akan melihat cara menghitung energi ionisasi dan bagaimana konsep ini terkait dengan sifat-sifat keperiodikan unsur. Akhirnya, kita akan menyebutkan lokasi di mana konsep-konsep ini dapat diterapkan.
Jari-jari Atom
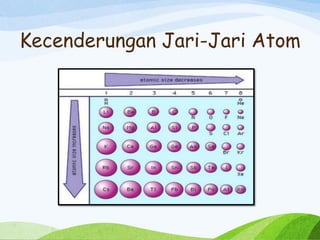
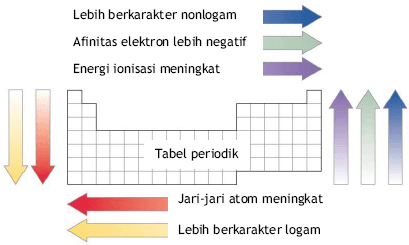
Jari-jari atom adalah jarak antara inti atom dan elektron terluar dalam sebuah atom. Jari-jari atom dapat berbeda-beda tergantung pada unsur yang bersangkutan. Pada umumnya, jari-jari atom lebih besar untuk unsur-unsur yang terletak di bagian kiri tabel periodik, dan lebih kecil untuk unsur-unsur yang terletak di bagian kanan tabel periodik. Hal ini disebabkan oleh perbedaan daya tarik antara inti atom dan elektron terluar. Semakin banyak proton dalam inti atom, semakin besar daya tariknya terhadap elektron dan semakin kecil jari-jari atomnya.
Energi Ionisasi
Energi ionisasi adalah energi yang dibutuhkan untuk mengionisasi satu mol atom di dalam fase gas. Proses pengionan ini melibatkan penghilangan satu atau lebih elektron dari atom tersebut. Energi ionisasi dapat diukur dalam satuan kilojoule per mol (kJ/mol). Semakin besar energi ionisasi suatu atom, semakin sulit untuk menghilangkan elektron-elektron dari atom tersebut.
Apa Itu Jari-jari Atom?
Jari-jari atom jugalah salah satu konsep penting dalam ilmu kimia. Jari-jari atom mengacu pada jarak antara inti atom dan elektron terluar dalam sebuah atom. Jarak ini dapat bervariasi tergantung pada unsur kimia yang bersangkutan. Pada umumnya, jari-jari atom cenderung lebih besar untuk unsur-unsur yang terletak di bagian kiri tabel periodik, dan lebih kecil untuk unsur-unsur yang terletak di bagian kanan tabel periodik. Hal ini disebabkan oleh pengaruh daya tarik yang berbeda antara inti atom dan elektron terluar. Semakin banyak proton dalam inti atom, semakin besar daya tariknya terhadap elektron dan semakin kecil jari-jari atomnya.
Apa Itu Energi Ionisasi?
Energi ionisasi adalah energi yang diperlukan untuk mengionisasi satu mol atom di dalam fase gas. Proses pengionan ini melibatkan penghilangan satu atau lebih elektron dari atom tersebut. Energi ionisasi dapat diukur dalam satuan kilojoule per mol (kJ/mol). Semakin besar energi ionisasi suatu atom, semakin sulit untuk menghilangkan elektron-elektron dari atom tersebut.

Keuntungan dari Jari-jari Atom dan Energi Ionisasi
Pengetahuan tentang jari-jari atom dan energi ionisasi memiliki sejumlah manfaat dalam ilmu kimia. Berikut adalah beberapa keuntungan dari mempelajari konsep-konsep ini:
Keuntungan Jari-jari Atom:
1. Memahami Sifat-sifat Fisik Unsur: Jari-jari atom mempengaruhi sifat-sifat fisik unsur, seperti titik lebur dan titik didih. Unsur dengan jari-jari atom yang besar cenderung memiliki titik lebur dan titik didih yang rendah, sedangkan unsur dengan jari-jari atom yang kecil cenderung memiliki titik lebur dan titik didih yang tinggi. Ini karena jari-jari atom yang lebih besar memberikan lebih banyak ruang bagi atom untuk bergerak dalam keadaan padat atau cair.
2. Menjelaskan Sifat Kimia Unsur: Jari-jari atom juga dapat digunakan untuk memprediksi sifat kimia unsur. Unsur dengan jari-jari atom yang besar cenderung lebih reaktif dan cenderung membentuk senyawa dengan mudah. Hal ini disebabkan oleh fakta bahwa elektron-elektron di kulit terluar atom dengan jari-jari atom besar berada lebih jauh dari inti atom dan oleh karena itu lebih mudah terlibat dalam reaksi kimia.
Keuntungan Energi Ionisasi:
1. Menentukan Reaktivitas Unsur: Energi ionisasi dapat digunakan untuk memprediksi reaktivitas unsur. Unsur dengan energi ionisasi rendah cenderung lebih reaktif karena lebih mudah untuk menghilangkan elektron terluar mereka. Sebaliknya, unsur dengan energi ionisasi tinggi cenderung kurang reaktif karena lebih sulit untuk menghilangkan elektron terluar mereka.
2. Memahami Pola Periodik Unsur: Energi ionisasi juga membantu dalam memahami pola periodik unsur. Pada umumnya, energi ionisasi cenderung meningkat dari kiri ke kanan dalam satu periode tabel periodik dan menurun dari atas ke bawah dalam satu golongan tabel periodik. Peningkatan energi ionisasi dari kiri ke kanan disebabkan oleh peningkatan daya tarik inti atom terhadap elektron terluar. Sedangkan penurunan energi ionisasi dari atas ke bawah disebabkan oleh peningkatan jarak antara inti atom dengan elektron terluar dan oleh karena itu, penurunan daya tarik inti atom terhadap elektron terluar.

Kekurangan dari Jari-jari Atom dan Energi Ionisasi
Seperti halnya konsep-konsep ilmiah lainnya, jari-jari atom dan energi ionisasi juga memiliki beberapa keterbatasan. Berikut adalah beberapa kekurangan dari konsep-konsep ini:
Kekurangan Jari-jari Atom:
1. Ukuran Terdefinisi pada Atom Isolasi: Konsep jari-jari atom hanya berlaku untuk atom dalam keadaan terisolasi. Ketika atom membentuk senyawa atau ikatan kimia, jari-jari atom dapat mengalami perubahan sebagai hasil dari interaksi dengan atom lain.
2. Kesulitan dalam Penentuan Tepat Jari-jari Atom: Dalam beberapa kasus, penentuan jari-jari atom yang tepat dapat menjadi sulit. Hal ini terutama terjadi pada unsur-unsur transisi yang cenderung membentuk ikatan yang kompleks dan memiliki jari-jari atom yang dapat bervariasi tergantung pada kondisi lingkungan.
Kekurangan Energi Ionisasi:
1. Pengaruh Lingkungan: Energi ionisasi dapat dipengaruhi oleh kondisi lingkungan seperti tekanan dan suhu. Oleh karena itu, nilai energi ionisasi yang diukur pada kondisi standar mungkin tidak selalu mencerminkan nilai yang sebenarnya dalam kondisi lingkungan yang berbeda.
2. Perbedaan dalam Pengukuran Energi Ionisasi: Nilai energi ionisasi yang tercatat dalam berbagai sumber dapat sedikit berbeda satu sama lain, tergantung pada metode pengukuran yang digunakan. Oleh karena itu, dalam literatur, sering kali disediakan kisaran nilai energi ionisasi yang memungkinkan untuk setiap unsur.
Cara Menghitung Energi Ionisasi
Energi ionisasi dapat dihitung dengan menggunakan persamaan matematis yang memperhitungkan jumlah energi yang diperlukan untuk menghilangkan elektron dari atom. Persamaan umum untuk menghitung energi ionisasi adalah sebagai berikut:
Energi Ionisasi = Energi Total Atom Terionisasi – Energi Total Atom Netral
Di mana, energi total atom terionisasi adalah jumlah energi yang diperlukan untuk menghilangkan satu atau lebih elektron dari atom, sementara energi total atom netral adalah energi total dari atom sebelum elektron terionisasi. Perbedaan antara energi total atom terionisasi dan energi total atom netral memberikan energi ionisasi.
Pemesanan dan Lokasi
Jika Anda ingin mempelajari lebih lanjut tentang jari-jari atom dan energi ionisasi, Anda dapat mengunjungi berbagai sumber informasi yang tersedia secara online, termasuk buku referensi kimia, artikel ilmiah, dan situs web pendidikan. Beberapa sumber yang dapat dijadikan referensi adalah:
1. Buku-buku kimia yang mencakup topik jari-jari atom dan energi ionisasi.
2. Artikel ilmiah di jurnal kimia yang membahas penelitian terkini tentang konsep-konsep ini.
3. Situs web pendidikan kimia yang menyediakan materi pembelajaran yang lengkap tentang jari-jari atom dan energi ionisasi.
Anda juga dapat mengunjungi perpustakaan lokal atau pusat sumber daya pendidikan untuk mencari referensi tambahan. Jika Anda tertarik untuk mendalami konsep-konsep ini lebih lanjut, Anda juga dapat menghubungi universitas atau lembaga pendidikan setempat yang menawarkan program dalam ilmu kimia.


