Penurunan Dan Pembuktian Rumus Hukum Termodinamika
Penurunan Dan Pembuktian Rumus Hukum Termodinamika
Termodinamika adalah salah satu cabang ilmu fisika yang mempelajari perubahan energi, panas, dan kerja dalam suatu sistem. Dalam termodinamika, terdapat beberapa hukum yang menjadi dasar dalam memahami fenomena yang terjadi dalam sistem. Salah satu hukum yang penting dalam termodinamika adalah Hukum Termodinamika Pertama.
Apa Itu Hukum Termodinamika Pertama?
Hukum Termodinamika Pertama atau yang juga dikenal dengan Hukum Kekekalan Energi menyatakan bahwa energi dalam suatu sistem dapat berubah bentuk dari satu bentuk ke bentuk yang lain, namun jumlah total energi tetap konstan. Artinya, energi tidak dapat diciptakan atau dimusnahkan, namun hanya dapat diubah bentuknya. Hukum ini merujuk pada prinsip kekekalan energi yang merupakan prinsip dasar dalam fisika.
Siapa yang Menemukan Hukum Termodinamika Pertama?
Hukum Termodinamika Pertama pertama kali dirumuskan pada tahun 1847 oleh Hermann von Helmholtz, seorang fisikawan dan dokter berkebangsaan Jerman. Helmholtz menyimpulkan bahwa energi dapat berubah bentuk tapi tidak dapat diciptakan atau dimusnahkan.
Kapan Hukum Termodinamika Pertama Digunakan?
Hukum Termodinamika Pertama telah digunakan sejak dirumuskan oleh Helmholtz pada tahun 1847. Hukum ini menjadi dasar dalam mempelajari dan memahami perubahan energi dalam sistem, seperti dalam bidang termodinamika, fisika, kimia, dan rekayasa energi.
Dimana Hukum Termodinamika Pertama Berlaku?
Hukum Termodinamika Pertama berlaku untuk semua sistem fisika yang terjadi di alam semesta ini. Jika ada suatu perubahan energi dalam sistem, hukum ini akan selalu berlaku. Baik itu dalam sistem makroskopik seperti mesin dan reaktor nuklir, maupun dalam sistem mikroskopik seperti partikel dan atom.
Bagaimana Hukum Termodinamika Pertama Bekerja?
Hukum Termodinamika Pertama bekerja dengan memperhatikan perubahan energi dalam sistem. Setiap perubahan energi dalam sistem dapat dianggap sebagai hasil dari panas yang masuk atau keluar dari sistem serta kerja yang dilakukan oleh sistem atau pada sistem. Dalam persamaan matematika, hukum ini dapat dirumuskan sebagai berikut:
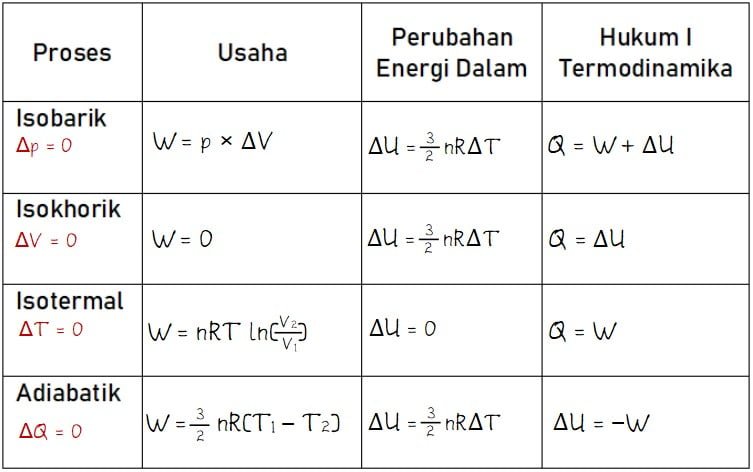
Apa Itu Proses Isotermik dalam Termodinamika Gas Ideal?
Proses isotermik adalah suatu proses dalam termodinamika dimana gas ideal mengalami perubahan suhu tetap atau konstan. Dalam proses ini, gas ideal mengalami perubahan volume dengan tetap mempertahankan tekanan dan suhu yang konstan. Proses isotermik sering digunakan dalam pembuatan mesin-mesin termodinamika seperti mesin uap dan mesin pembakaran dalam.
Siapa yang Menemukan Proses Isotermik dalam Termodinamika Gas Ideal?
Proses isotermik dalam termodinamika gas ideal pertama kali dijelaskan oleh seorang fisikawan bernama James Prescott Joule pada tahun 1843. Joule menemukan bahwa pada suatu proses isotermik, gas ideal yang terisolasi dari lingkungannya akan mengalami perubahan volume tanpa mengalami perubahan suhu.
Kapan Proses Isotermik dalam Termodinamika Gas Ideal Digunakan?
Proses isotermik dalam termodinamika gas ideal banyak digunakan dalam bidang industri dan rekayasa. Proses ini sering digunakan dalam pembuatan mesin-mesin seperti mesin uap, mesin pembakaran dalam, dan kompresor. Selain itu, proses isotermik juga digunakan dalam perhitungan dan analisis perubahan energi dalam sistem gas ideal yang mengalami perubahan volume dengan tetap mempertahankan suhu konstan.
Dimana Proses Isotermik dalam Termodinamika Gas Ideal Berlaku?
Proses isotermik dalam termodinamika gas ideal berlaku dalam sistem gas ideal yang terisolasi dari lingkungannya. Sistem tersebut dapat berupa cylinder yang berisi gas ideal atau ruang bakar pada mesin pembakaran dalam. Selama proses isotermik berlangsung, suhu dan tekanan gas ideal di dalam sistem tetap konstan.
Bagaimana Proses Isotermik dalam Termodinamika Gas Ideal Bekerja?
Proses isotermik dalam termodinamika gas ideal bekerja dengan mempertahankan suhu konstan di dalam sistem. Pada saat gas ideal mengalami perubahan volume, tekanan gas ideal juga akan berubah sesuai dengan hukum termodinamika gas ideal. Dalam persamaan matematika, proses isotermik dapat dijelaskan menggunakan persamaan berikut:

Apa Itu Hukum Termodinamika Pertama?
Hukum Termodinamika Pertama atau yang juga dikenal dengan Hukum Kekekalan Energi menyatakan bahwa energi dalam suatu sistem dapat berubah bentuk dari satu bentuk ke bentuk yang lain, namun jumlah total energi tetap konstan. Artinya, energi tidak dapat diciptakan atau dimusnahkan, namun hanya dapat diubah bentuknya. Hukum ini merujuk pada prinsip kekekalan energi yang merupakan prinsip dasar dalam fisika.
Siapa yang Menemukan Hukum Termodinamika Pertama?
Hukum Termodinamika Pertama pertama kali dirumuskan pada tahun 1847 oleh Hermann von Helmholtz, seorang fisikawan dan dokter berkebangsaan Jerman. Helmholtz menyimpulkan bahwa energi dapat berubah bentuk tapi tidak dapat diciptakan atau dimusnahkan.
Kapan Hukum Termodinamika Pertama Digunakan?
Hukum Termodinamika Pertama telah digunakan sejak dirumuskan oleh Helmholtz pada tahun 1847. Hukum ini menjadi dasar dalam mempelajari dan memahami perubahan energi dalam sistem, seperti dalam bidang termodinamika, fisika, kimia, dan rekayasa energi.
Dimana Hukum Termodinamika Pertama Berlaku?
Hukum Termodinamika Pertama berlaku untuk semua sistem fisika yang terjadi di alam semesta ini. Jika ada suatu perubahan energi dalam sistem, hukum ini akan selalu berlaku. Baik itu dalam sistem makroskopik seperti mesin dan reaktor nuklir, maupun dalam sistem mikroskopik seperti partikel dan atom.
Bagaimana Hukum Termodinamika Pertama Bekerja?
Hukum Termodinamika Pertama bekerja dengan memperhatikan perubahan energi dalam sistem. Setiap perubahan energi dalam sistem dapat dianggap sebagai hasil dari panas yang masuk atau keluar dari sistem serta kerja yang dilakukan oleh sistem atau pada sistem. Dalam persamaan matematika, hukum ini dapat dirumuskan sebagai berikut:
Apa Itu Hukum Termodinamika Kedua?
Hukum Termodinamika Kedua atau yang juga dikenal sebagai Hukum Entropi menyatakan bahwa entropi dalam suatu sistem yang terisolasi akan selalu meningkat atau setidaknya tetap konstan. Entropi merupakan suatu besaran yang menggambarkan tingkat ketidaturan atau kekacauan dalam sistem. Hukum ini merujuk pada prinsip ketidemungkinan terjadinya perubahan spontan dari keadaan yang tidak teratur menjadi teratur secara sendirinya.
Siapa yang Menemukan Hukum Termodinamika Kedua?
Hukum Termodinamika Kedua pertama kali dirumuskan pada tahun 1850 oleh seorang fisikawan berkebangsaan Selandia Baru bernama William Thomson, yang lebih dikenal dengan nama Lord Kelvin. Thomson menyatakan bahwa tidak mungkin ada suatu proses yang bekerja tanpa menimbulkan perubahan entropi dalam suatu sistem yang terisolasi.
Kapan Hukum Termodinamika Kedua Digunakan?
Hukum Termodinamika Kedua telah digunakan sejak dirumuskan oleh Thomson pada tahun 1850. Hukum ini menjadi dasar dalam memahami perubahan entropi dalam sistem yang terisolasi. Hukum ini banyak digunakan dalam bidang termodinamika, fisika, kimia, dan rekayasa. Selain itu, hukum ini juga digunakan untuk menjelaskan mengapa mesin-mesin termodinamika memiliki efisiensi yang terbatas.
Dimana Hukum Termodinamika Kedua Berlaku?
Hukum Termodinamika Kedua berlaku untuk semua sistem yang terisolasi. Sistem yang terisolasi adalah sistem yang tidak memiliki pertukaran energi atau materi dengan lingkungannya. Dalam sistem yang terisolasi, entropi akan selalu meningkat atau setidaknya tetap konstan sehingga tidak mungkin ada perubahan spontan dari keadaan yang tidak teratur menjadi teratur tanpa adanya energi atau kerja eksternal yang dilakukan pada sistem.
Bagaimana Hukum Termodinamika Kedua Bekerja?
Hukum Termodinamika Kedua bekerja dengan mempertimbangkan perubahan entropi dalam sistem. Perubahan entropi terjadi karena adanya perubahan energi atau panas yang masuk atau keluar dari sistem, serta kerja yang dilakukan oleh sistem atau pada sistem. Dalam persamaan matematika, hukum ini dapat dirumuskan sebagai berikut:

Apa Itu Hukum Termodinamika Pertama dan Kedua?
Hukum Termodinamika Pertama dan Kedua adalah dua hukum dasar dalam termodinamika yang mempelajari perubahan energi, panas, dan kerja dalam suatu sistem. Hukum Termodinamika Pertama menyatakan bahwa energi dalam suatu sistem dapat berubah bentuk dari satu bentuk ke bentuk yang lain, namun jumlah total energi tetap konstan. Sedangkan Hukum Termodinamika Kedua menyatakan bahwa entropi dalam suatu sistem yang terisolasi akan selalu meningkat atau setidaknya tetap konstan.
Siapa yang Menemukan Hukum Termodinamika Pertama dan Kedua?
Hukum Termodinamika Pertama pertama kali dirumuskan pada tahun 1847 oleh Hermann von Helmholtz, sedangkan Hukum Termodinamika Kedua pertama kali dirumuskan pada tahun 1850 oleh William Thomson atau Lord Kelvin.
Kapan Hukum Termodinamika Pertama dan Kedua Digunakan?
Hukum Termodinamika Pertama dan Kedua telah digunakan sejak ditemukannya masing-masing hukum tersebut. Kedua hukum ini menjadi dasar dalam mempelajari dan memahami perubahan energi dan entropi dalam sistem, serta banyak digunakan dalam bidang termodinamika, fisika, kimia, dan rekayasa energi.
Dimana Hukum Termodinamika Pertama dan Kedua Berlaku?
Hukum Termodinamika Pertama dan Kedua berlaku untuk semua sistem fisika yang terjadi di alam semesta ini. Jika ada suatu perubahan energi atau entropi dalam sistem, hukum-hukum tersebut akan selalu berlaku. Baik itu dalam sistem makroskopik seperti mesin dan reaktor nuklir, maupun dalam sistem mikroskopik seperti partikel dan atom.
Bagaimana Hukum Termodinamika Pertama dan Kedua Bekerja?
Hukum Termodinamika Pertama bekerja dengan memperhatikan perubahan energi dalam sistem, sedangkan Hukum Termodinamika Kedua bekerja dengan mempertimbangkan perubahan entropi dalam sistem. Setiap perubahan energi atau entropi dalam sistem dapat dianggap sebagai hasil dari panas yang masuk atau keluar dari sistem serta kerja yang dilakukan oleh sistem atau pada sistem.
Kesimpulan
Hukum Termodinamika Pertama menyatakan bahwa energi dalam suatu sistem dapat berubah bentuk dari satu bentuk ke bentuk yang lain, namun jumlah total energi tetap konstan. Hukum ini pertama kali dirumuskan oleh Hermann von Helmholtz pada tahun 1847. Hukum Termodinamika Kedua, yang juga dikenal sebagai Hukum Entropi, menyatakan bahwa entropi dalam suatu sistem yang terisolasi akan selalu meningkat atau setidaknya tetap konstan. Hukum ini pertama kali dirumuskan oleh William Thomson atau Lord Kelvin pada tahun 1850. Kedua hukum ini berlaku untuk semua sistem fisika yang terjadi di alam semesta ini dan banyak digunakan dalam bidang termodinamika, fisika, kimia, dan rekayasa energi.



