Apa itu Hukum Proust?
Hukum Proust, juga dikenal sebagai Hukum Perbandingan Tetap, adalah prinsip dasar dalam kimia yang menyatakan bahwa “ketika unsur-unsur bergabung untuk membentuk senyawa, mereka melakukannya dalam perbandingan massa yang tetap”. Hukum ini pertama kali ditemukan oleh seorang ilmuwan Prancis bernama Joseph Louis Proust pada abad ke-18. Proust menemukan bahwa hubungan antara massa dan komposisi senyawa tidak dapat diubah, sehingga memperoleh pengetahuan penting tentang sifat-sifat senyawa kimia.
Hukum Proust dalam Bentuk Rumus
Hukum Proust dapat disederhanakan dalam bentuk rumus matematika yang mudah dipahami, yaitu:

Rumus ini menggambarkan bahwa perbandingan massa antara unsur-unsur dalam suatu senyawa kimia akan selalu tetap dan tidak berubah, terlepas dari banyaknya massa yang terlibat. Hukum Proust juga dapat diterapkan dalam perbandingan volume senyawa, tetapi dalam konteks ini kita akan fokus pada perbandingan massa.
Contoh Soal Hukum Proust
Untuk lebih memahami penerapan Hukum Proust, berikut adalah beberapa contoh soal yang dapat membantu Anda:
Contoh Soal 1:

Sebuah senyawa terdiri dari dua unsur, A dan B. Jika diketahui massa unsur A adalah 20 gram dan massa unsur B adalah 30 gram, tentukan perbandingan massa antara A dan B dalam senyawa tersebut.
Jawaban:
Menggunakan Hukum Proust, kita dapat menyimpulkan bahwa perbandingan massa A dan B dalam senyawa akan tetap. Dalam contoh ini, massa A adalah 20 gram dan massa B adalah 30 gram. Oleh karena itu, perbandingan massa A dan B adalah 20:30 atau 2:3.
Contoh Soal 2:
Sebuah senyawa terdiri dari tiga unsur, X, Y, dan Z. Jika diketahui massa unsur X adalah 10 gram, massa unsur Y adalah 20 gram, dan massa unsur Z adalah 30 gram, tentukan perbandingan massa antara X, Y, dan Z dalam senyawa tersebut.
Jawaban:
Menggunakan Hukum Proust, kita dapat menyimpulkan bahwa perbandingan massa X, Y, dan Z dalam senyawa akan tetap. Berdasarkan data yang diberikan, perbandingan massa X, Y, dan Z adalah 10:20:30 atau 1:2:3.
Bagaimana Hukum Proust Bekerja?
Hukum Proust berguna dalam menyediakan dasar untuk memahami hubungan antara massa unsur-unsur dalam senyawa kimia. Hukum ini didasarkan pada konsep bahwa atom adalah penyusun dasar semua materi, dan ketika atom-atom ini bergabung untuk membentuk senyawa, mereka melakukannya dalam perbandingan massa yang tetap.
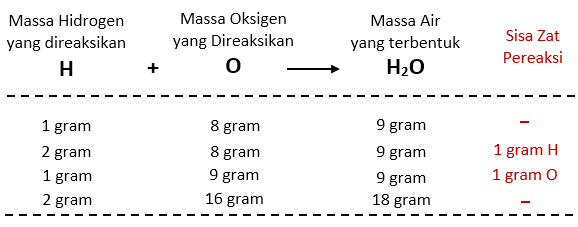
Sebagai contoh, jika kita mengamati senyawa air (H2O), Hukum Proust menunjukkan bahwa setiap molekul air terdiri dari 2 atom hidrogen (H) dan 1 atom oksigen (O). Massa hidrogen adalah sekitar 1 gram per mol, sedangkan massa oksigen adalah sekitar 16 gram per mol. Oleh karena itu, berdasarkan perbandingan massa ini, kita dapat menyimpulkan bahwa setiap gram hidrogen akan berhubungan dengan 8 gram oksigen dalam senyawa air.
Mengapa Hukum Proust Penting dalam Kimia?
Hukum Proust memiliki signifikansi besar dalam kimia karena memberikan pemahaman yang mendalam tentang perbandingan massa antara unsur-unsur dalam senyawa. Hal ini mengarah pada beberapa penerapan penting dalam ilmu kimia, termasuk:
1. Stoikiometri: Hukum Proust membentuk dasar stoikiometri, cabang kimia yang mempelajari perbandingan massa dan hubungan kuantitatif dalam reaksi kimia. Menggunakan rasio massa yang diberikan oleh Hukum Proust, kita dapat menghitung jumlah reaktan yang dibutuhkan atau jumlah produk yang dihasilkan dalam suatu reaksi kimia.
2. Komposisi Senyawa: Hukum Proust memungkinkan kita untuk menentukan komposisi persen suatu senyawa kimia dengan menghitung perbandingan massa yang tetap antara unsur-unsur penyusunnya. Hal ini sangat penting untuk identifikasi senyawa kimia, analisis kualitatif, dan pengendalian kualitas dalam industri kimia.
3. Penemuan Unsur Baru: Hukum Proust juga telah terbukti sangat berguna dalam menemukan unsur-unsur baru. Dengan mempelajari dan menganalisis perbandingan massa dalam senyawa yang belum diketahui komposisinya, ilmuwan dapat mengindentifikasi unsur-unsur baru yang sebelumnya tidak diketahui atau telah ditemukan dalam jumlah yang sangat kecil.
Berapa Lama Hukum Proust Ditemukan?
Hukum Proust pertama kali ditemukan oleh seorang ilmuwan Prancis bernama Joseph Louis Proust pada abad ke-18. Proust, yang lahir pada tahun 1754 dan meninggal pada tahun 1826, adalah seorang ahli kimia yang banyak berkontribusi dalam pengembangan ilmu kimia pada masanya.
Pada tahun 1799, Proust menerbitkan sebuah karya berjudul “Les Éléments de chimie, in 2 vol.” (Elemen Kimia), di mana ia mengemukakan Hukum Proust. Dalam karyanya tersebut, Proust membahas hasil penelitiannya tentang perbandingan massa dalam senyawa kimia dan menunjukkan bahwa perbandingan massa ini tidak bergantung pada ukuran atau kombinasi spesifik dari unsur-unsur penyusunya.
Dimana Hukum Proust Dapat Diterapkan?
Hukum Proust dapat diterapkan dalam berbagai situasi dan konteks. Beberapa contoh aplikasi Hukum Proust antara lain:
1. Sintesis Senyawa: Dalam sintesis senyawa kimia, Hukum Proust digunakan untuk memastikan bahwa reaktan yang digunakan dalam pembuatan senyawa memiliki perbandingan massa yang tepat. Dengan memastikan perbandingan massa yang tetap, reaksi dapat berjalan dengan efisien dan menghasilkan senyawa yang diinginkan.
2. Analisis Kualitatif: Dalam analisis kualitatif, Hukum Proust digunakan untuk memastikan adanya keberadaan unsur-unsur tertentu dalam suatu senyawa. Dengan mengetahui perbandingan massa yang tetap antara unsur-unsur penyusunnya, kita dapat mengidentifikasi unsur-unsur tersebut melalui analisis kualitatif.
3. Penelitian Ilmiah: Hukum Proust juga digunakan dalam penelitian ilmiah untuk mempelajari perbandingan massa dalam senyawa yang belum diketahui. Dengan menganalisis perbandingan massa ini, para ilmuwan dapat mengidentifikasi unsur-unsur yang ada dalam senyawa tersebut dan memperoleh pengetahuan baru tentang sifat-sifat dan reaktivitas senyawa tersebut.
Bagaimana Cara Menggunakan Hukum Proust dalam Perhitungan?
Untuk menggunakan Hukum Proust dalam perhitungan, ikuti langkah-langkah berikut:
Langkah 1: Identifikasi unsur-unsur penyusun senyawa dan jumlah massanya.
Langkah 2: Tetapkan perbandingan massa antara unsur-unsur tersebut.
Langkah 3: Gunakan perbandingan massa untuk menghitung jumlah reaktan atau produk yang dibutuhkan dalam suatu reaksi kimia.
Sebagai contoh, jika kita ingin menghitung jumlah oksigen (O) yang dibutuhkan untuk mereaksikan dengan 10 gram hidrogen (H) dalam reaksi pembentukan air (H2O), kita dapat menggunakan Hukum Proust untuk menentukan perbandingan massa antara hidrogen dan oksigen dalam air, yaitu 2:16 atau 1:8. Dengan demikian, kita dapat menyimpulkan bahwa 10 gram hidrogen akan memerlukan 80 gram oksigen untuk membentuk air.
Kesimpulan
Hukum Proust, juga dikenal sebagai Hukum Perbandingan Tetap, adalah prinsip dasar dalam kimia yang menyatakan bahwa perbandingan massa antara unsur-unsur dalam suatu senyawa kimia akan selalu tetap dan tidak berubah. Hukum ini pertama kali ditemukan oleh Joseph Louis Proust pada abad ke-18 dan memiliki signifikansi penting dalam ilmu kimia.
Hukum Proust diterapkan dalam banyak aspek kimia, seperti stoikiometri, analisis kualitatif, sintesis senyawa, dan penelitian ilmiah. Dengan memahami dan menggunakan Hukum Proust, kita dapat menghitung jumlah reaktan atau produk dalam reaksi kimia, menentukan komposisi persen suatu senyawa, dan mengidentifikasi unsur-unsur tertentu dalam senyawa yang belum diketahui.
Hukum Proust mengajarkan kita bahwa dalam dunia senyawa kimia, perbandingan massa antara unsur-unsur adalah sangat penting, dan tidak dapat diubah. Hal ini baru merupakan permulaan untuk memahami fenomena yang lebih luas yang terjadi di dunia kimia, dan memberikan dasar yang kuat untuk pengembangan pengetahuan kita tentang sifat-sifat materi.