Jenis-jenis Ikatan Kimia
Setiap atom dalam suatu molekul dapat membentuk ikatan kimia dengan atom-atom lainnya. Ikatan kimia terbentuk melalui berbagai mekanisme, dan tergantung pada sifat atom yang terlibat. Secara umum, terdapat tiga jenis ikatan kimia utama yang dapat terbentuk antara atom-atom. Ketiga jenis ikatan tersebut adalah ikatan ion, ikatan kovalen, dan ikatan logam.
Ikatan Ion
Ikatan ion terjadi ketika satu atau lebih elektron ditransfer dari satu atom ke atom lainnya. Atom yang mendapatkan elektron akan membentuk ion negatif (anion), sedangkan atom yang kehilangan elektron akan membentuk ion positif (kation). Ikatan ion sering terjadi antara logam dan non-logam, terutama pada garam. Contohnya adalah ikatan antara natrium (Na) dan klorin (Cl) dalam garam meja (NaCl). Natrium kehilangan satu elektron dan membentuk ion Na+ yang positif, sedangkan klorin menerima satu elektron dan membentuk ion Cl- yang negatif. Hasilnya, terbentuklah ikatan ion antara ion Na+ dan Cl-.
Geometri Molekul dan Gaya Antarmolekul
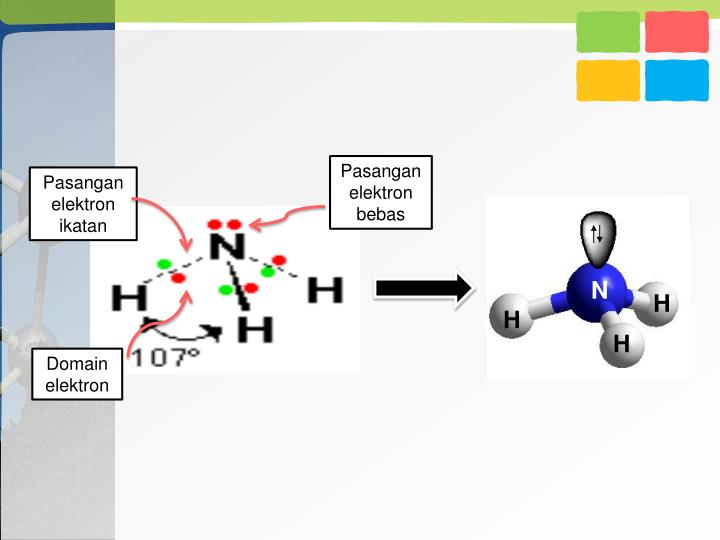
Geometri molekul dan gaya antarmolekul menjelaskan bagaimana atom-atom dalam suatu molekul terstruktur. Geometri molekul menyangkut susunan atom-atom dan bentuk molekul, sedangkan gaya antarmolekul berkaitan dengan interaksi antara molekul-molekul tersebut.
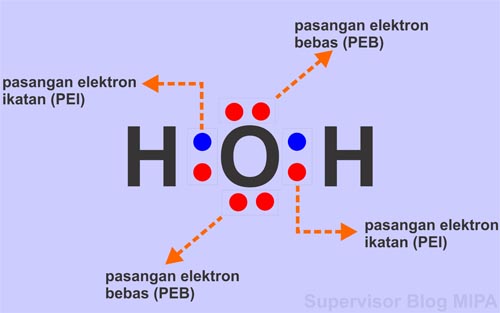
Geometri molekul dipengaruhi oleh konsep pasangan elektron terikat dan pasangan elektron bebas. Pasangan elektron terikat adalah pasangan elektron yang digunakan bersama dalam ikatan kimia antara atom-atom, sedangkan pasangan elektron bebas adalah pasangan elektron pada atom yang tidak terlibat dalam ikatan kimia. Jumlah elektron yang digunakan bersama dalam molekul N2, misalnya, adalah dua, sehingga terbentuk ikatan rangkap dua antara dua atom nitrogen.
Apa Itu Ikatan Kovalen?
Ikatan kovalen terjadi ketika dua atom saling berbagi pasangan elektron. Dalam ikatan kovalen, terdapat elektron-elektron yang digunakan bersama oleh dua atom, sehingga keduanya dapat mencapai konfigurasi elektron yang stabil. Ikatan kovalen lebih umum terjadi antara non-logam, seperti hidrogen (H2) atau oksigen (O2).
Cara Terbentuknya Ikatan Kovalen
Terdapat dua cara terbentuknya ikatan kovalen, yaitu ikatan kovalen satu arah (nonpolar) dan ikatan kovalen dua arah (polar). Dalam ikatan kovalen satu arah, pasangan elektron yang digunakan bersama oleh dua atom memiliki keelektronegativan yang sama, sehingga elektron-elektron tersebut berbagi secara merata. Contohnya adalah ikatan dalam hidrogen (H2), di mana kedua atom hidrogen memiliki keelektronegativan yang sama sehingga elektron-elektron yang digunakan bersama berbagi secara merata.
Sedangkan dalam ikatan kovalen dua arah, pasangan elektron yang digunakan bersama memiliki perbedaan keelektronegativan. Atom dengan keelektronegativan lebih tinggi menarik elektron-elektron dengan lebih kuat, sehingga terbentuk muatan parsial positif dan muatan parsial negatif di dalam molekul. Contohnya adalah ikatan antara hidrogen (H) dan oksigen (O) dalam molekul air (H2O). Oksigen memiliki keelektronegativan yang lebih tinggi daripada hidrogen, sehingga atom oksigen menarik elektron-elektron dengan lebih kuat, menghasilkan muatan negatif. Sementara itu, atom hidrogen yang berada di sebelah oksigen menjadi bermuatan positif.
Definisi Ikatan Kovalen
Ikatan kovalen adalah salah satu jenis ikatan kimia di mana dua atom saling berbagi pasangan elektron. Dalam ikatan kovalen, pasangan elektron yang digunakan bersama oleh dua atom memberikan stabilitas dan kekuatan pada molekul yang terbentuk.
Proses Terbentuknya Ikatan Kovalen
Proses terbentuknya ikatan kovalen dimulai ketika dua atom saling mendekat. Ketika kedua atom ini berada dalam jarak yang tepat, pasangan elektron yang digunakan bersama akan terbentuk di antara keduanya. Pasangan elektron yang terbentuk akan memberikan keduanya stabilitas elektronik, sehingga terbentuklah ikatan kovalen.
Hasil Terbentuknya Ikatan Kovalen
Hasil dari terbentuknya ikatan kovalen adalah molekul yang stabil. Pasangan elektron yang digunakan bersama memberikan kestabilan dan kekuatan pada molekul, sehingga ikatan kovalen menjadi salah satu ikatan kimia yang kuat. Selain itu, hasil dari ikatan kovalen juga dapat berupa senyawa kimia yang memiliki sifat-sifat khas, misalnya senyawa air (H2O) yang memiliki sifat-sifat seperti titik didih tinggi dan sifat polar.
Contoh Ikatan Kovalen
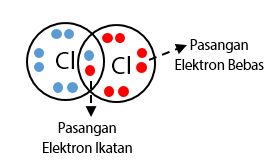
Contoh lain dari ikatan kovalen adalah ikatan dalam hidrogen klorida (HCl). Dalam molekul HCl, atom hidrogen dan atom klorin saling berbagi pasangan elektron, sehingga keduanya dapat mencapai stabilitas elektronik. Hidrogen menyerahkan elektronnya kepada klorin, sehingga terbentuklah muatan positif di atom hidrogen dan muatan negatif di atom klorin. Ikatan kovalen ini memberikan stabilitas dan kekuatan pada molekul HCl.
Kesimpulan
Secara umum, terdapat tiga jenis ikatan kimia utama yang dapat terbentuk antara atom-atom. Ketiga jenis ikatan tersebut adalah ikatan ion, ikatan kovalen, dan ikatan logam. Ikatan ion terjadi melalui transfer elektron, sedangkan ikatan kovalen terjadi melalui pembagian elektron dan ikatan logam terjadi melalui pengaturan elektron dalam molekul. Geometri molekul dan gaya antarmolekul memainkan peran penting dalam pembentukan dan sifat ikatan kimia. Ikatan kovalen terjadi ketika dua atom berbagi pasangan elektron, yang memberikan stabilitas pada molekul yang terbentuk.


