Halo semua! Pada kesempatan kali ini, kita akan membahas tentang pengertian bilangan kuantum dalam fisika dan jenis-jenisnya. Mari kita mulai pembahasan ini dengan mengenal apa itu bilangan kuantum.
Memahami Bilangan Kuantum
Bilangan kuantum merupakan konsep penting dalam fisika, terutama dalam memahami struktur dan perilaku atom serta partikel subatomik. Bilangan kuantum digunakan untuk menggambarkan keadaan energi, gerak, dan orbital elektron dalam atom. Dalam fisika atom, bilangan kuantum sering kali digunakan untuk mengidentifikasi dan memprediksi perilaku partikel-partikel elemen kimia, seperti elektron di sekitar inti atom.
Nantinya, bilangan kuantum akan memberikan informasi penting mengenai konfigurasi elektron, yaitu susunan dan perilaku elektron dalam sebuah atom. Dengan memahami bilangan kuantum, kita dapat mengetahui bagaimana suatu elektron berperilaku dalam tahap tertentu.
Jenis-Jenis Bilangan Kuantum
Berikut ini adalah beberapa jenis bilangan kuantum yang umum digunakan dalam fisika:
Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) merupakan bilangan kuantum pertama yang menentukan energi dan ukuran orbital elektron. Nilai n harus selalu angka bulat positif, dan semakin besar nilai n, semakin tinggi energi elektron dan juga semakin jauh orbital elektron dari inti atom.
Seperti yang dapat dilihat pada grafik di atas, garis berwarna merah melambangkan tingkat energi orbital yang semakin tinggi seiring dengan kenaikan nilai n.
Bilangan Kuantum Azimutal (l)
Bilangan kuantum azimutal (l) menggambarkan bentuk orbital elektron dalam atom. Nilai l berkaitan erat dengan bilangan kuantum utama (n), di mana nilai l selalu lebih kecil dari n. Bilangan kuantum azimutal ini digunakan untuk mengklasifikasikan orbital- orbital dalam subkulit elektron, yang akan mempengaruhi tingkat energi elektron dalam atom.
Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik (m) menunjukkan arah orbital dari elektron dalam atom. Nilai m berkisar dari -l hingga l, di mana l adalah bilangan kuantum azimutal. Dengan adanya bilangan kuantum magnetik ini, kita dapat menentukan berapa jumlah orbital dalam suatu subkulit serta beberapa bentuk orbital yang mungkin terbentuk.
Bilangan Kuantum Spin (s)
Bilangan kuantum spin (s) digunakan untuk menggambarkan arah perputaran elektron pada sumbu magnetik. Nilai s selalu -1/2 atau +1/2. Bilangan ini menandakan adanya dua kemungkinan orientasi perputaran elektron yang dibedakan oleh spin atas atau bawah.

Itulah empat jenis bilangan kuantum yang paling umum digunakan dalam fisika. Setiap jenis bilangan kuantum memberikan informasi yang berbeda tentang suatu elektron dalam atom, dan memainkan peran penting dalam memahami perilaku partikel subatomik.
Konfigurasi Elektron
Konfigurasi elektron mengacu pada susunan elektron dalam suatu atom atau ion. Konfigurasi elektron ini dapat dinyatakan dengan menggunakan simbol bilangan kuantum. Untuk memahami konfigurasi elektron, mari kita bahas langkahnya.
Langkah Pertama: Menentukan Bilangan Kuantum Utama (n)
Bilangan kuantum utama (n) menunjukkan tingkat energi orbital elektron. Nilai n dapat berupa angka bulat positif, misalnya n=1, n=2, n=3, dan seterusnya. Mulai dengan n=1 untuk orbital dengan tingkat energi terendah.
Langkah Kedua: Menentukan Bilangan Kuantum Azimutal (l)
Bilangan kuantum azimutal (l) menunjukkan bentuk orbital elektron. Nilai l berkaitan dengan bilangan kuantum utama (n) dan memiliki rentang nilai mulai dari 0 hingga (n-1). Misalnya, jika n=2, maka l dapat bernilai 0 atau 1. Jika n=3, maka l dapat bernilai 0, 1, atau 2, dan seterusnya.
Langkah Ketiga: Menentukan Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik (m) menunjukkan arah orbital elektron dalam atom. Nilai m berkaitan dengan bilangan kuantum azimutal (l), di mana nilai m berkisar dari -l hingga l. Sebagai contoh, jika l=1, maka m bisa bernilai -1, 0, atau 1.
Langkah Keempat: Menentukan Bilangan Kuantum Spin (s)
Bilangan kuantum spin (s) menunjukkan arah perputaran elektron dalam atom. Nilai s selalu -1/2 atau +1/2. Perlu diingat bahwa setiap subkulit elektron hanya dapat menampung dua elektron dengan spin yang berlawanan.
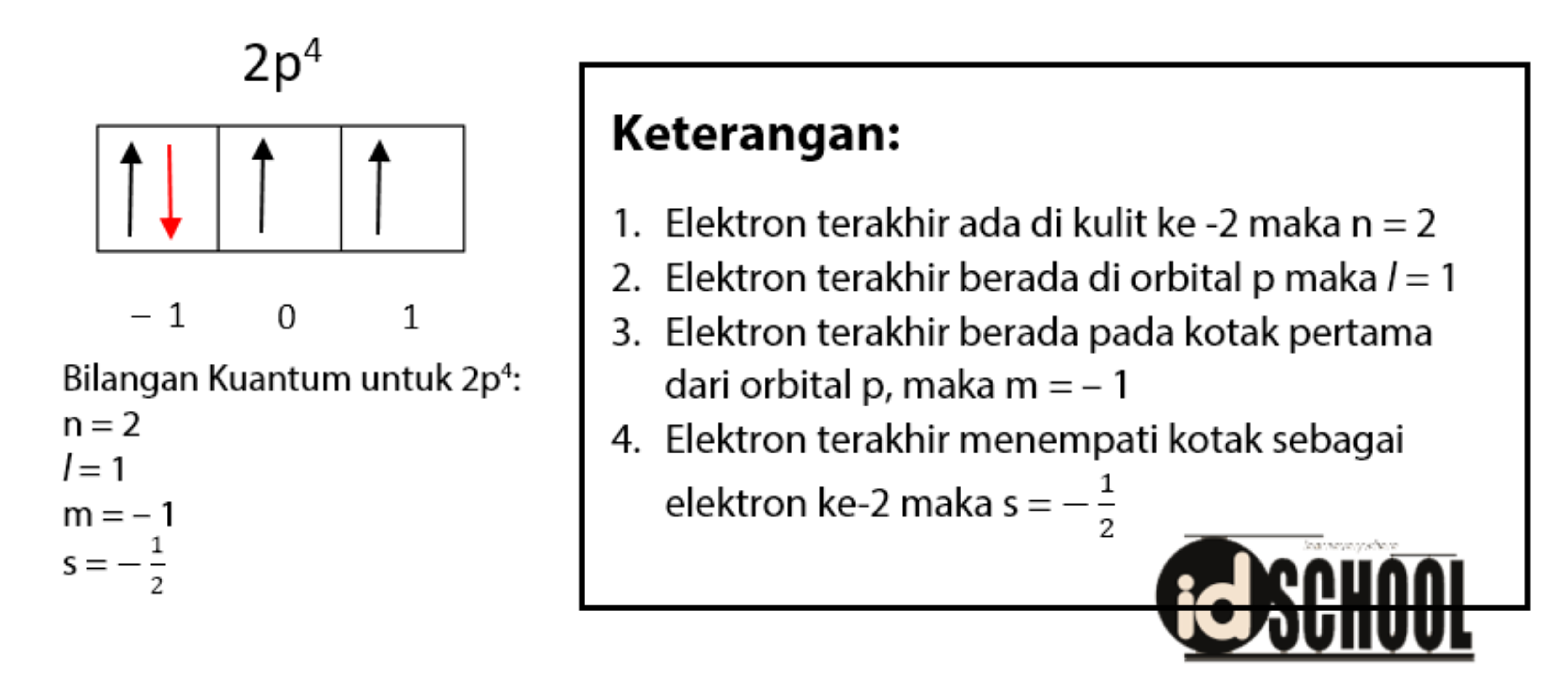
Contoh Konfigurasi Elektron
Mari kita lihat contoh konfigurasi elektron untuk atom karbon (C) dengan nomor atom 6. Berdasarkan urutan penempatan elektron, kita menentukan konfigurasi elektron sebagai berikut:
Konfigurasi elektron karbon (C) adalah 1s2 2s2 2p2. Maksud dari simbol bilangan kuantum tersebut adalah:
- Elektron pertama berada di subkulit 1s dengan spin atas (+1/2). (1s1)
- Elektron kedua juga berada di subkulit 1s dengan spin bawah (-1/2). (1s1 1s1)
- Elektron ketiga dan keempat berada di subkulit 2s dengan spin atas dan bawah. (1s2 2s1 2s1)
- Elektron kelima dan keenam berada di subkulit 2p dengan spin atas dan bawah. (1s2 2s2 2p1 2p1)
Apa yang dapat kita simpulkan dari penjelasan di atas?
Dari penjelasan di atas, kita dapat menyimpulkan bahwa bilangan kuantum adalah parameter yang digunakan untuk menggambarkan keadaan energi, gerak, dan orbital elektron dalam atom. Terdapat empat jenis bilangan kuantum utama, yaitu bilangan kuantum utama (n), azimutal (l), magnetik (m), dan spin (s). Nilai bilangan kuantum n menentukan tingkat energi elektron dalam orbitalnya, sedangkan nilai l, m, dan s menunjukkan bentuk, arah, dan spin dari elektron dalam atom. Dengan memahami konfigurasi elektron dan bilangan kuantum, kita dapat memprediksi perilaku dan sifat-sifat partikel subatomik serta memahami struktur atom yang lebih dalam.

Jadi, kini kita telah memahami pengertian bilangan kuantum dalam fisika dan jenis-jenisnya. Bilangan kuantum merupakan konsep penting dalam memahami struktur dan perilaku atom serta partikel subatomik. Terdapat empat jenis bilangan kuantum utama, yaitu bilangan kuantum utama (n), azimutal (l), magnetik (m), dan spin (s), yang memberikan informasi tentang tingkat energi, bentuk orbital, arah orbital, dan spin elektron dalam atom. Dengan memahami konfigurasi elektron dan bilangan kuantum, kita dapat memprediksi perilaku partikel subatomik dan meningkatkan pemahaman kita tentang struktur atom.
Contoh Penggunaan Bilangan Kuantum dalam Fisika
Untuk memperjelas pemahaman kita tentang penggunaan bilangan kuantum dalam fisika, berikut ini adalah contoh penerapannya dalam salah satu bidang ilmu fisika, yaitu spektroskopi.
Apa Itu Spektroskopi?
Spektroskopi adalah cabang ilmu fisika yang mempelajari interaksi antara materi dan radiasi elektromagnetik. Dalam spektroskopi, bilangan kuantum digunakan untuk mengidentifikasi dan menganalisis sifat-sifat atom dan molekul berdasarkan karakteristik spektrum yang dihasilkan saat materi berinteraksi dengan radiasi elektromagnetik.
Bagaimana Bilangan Kuantum Digunakan dalam Spektroskopi?
Dalam spektroskopi, bilangan kuantum digunakan untuk menggambarkan tingkat energi orbital elektron dalam atom atau molekul. Ketika atom atau molekul menerima atau memancarkan energi dalam bentuk radiasi elektromagnetik, perubahan energi yang terjadi terkait langsung dengan perubahan bilangan kuantum.
Proses Spektroskopi
Proses spektroskopi dimulai dengan penyinaran atau pemberian energi ke materi yang akan diteliti. Setelah materi menerima energi, elektron-elektron pada atom atau molekul akan mengalami transisi energi dan berpindah dari tingkat energi yang rendah ke tingkat energi yang lebih tinggi atau sebaliknya. Transisi energi ini terkait dengan perubahan bilangan kuantum di dalam atom atau molekul.
Contoh Penggunaan Bilangan Kuantum dalam Spektroskopi
Sebagai contoh, berdasarkan penggunaan bilangan kuantum dalam spektroskopi, kita dapat mengamati spektrum emisi atom hidrogen. Atom hidrogen memiliki satu elektron di kulit terluarnya. Ketika atom hidrogen menerima energi, elektron akan berpindah dari tingkat energi yang lebih rendah (misalnya n=1) ke tingkat energi yang lebih tinggi (misalnya n=2). Peralihan ini terkait dengan perubahan bilangan kuantum.
Dalam spektroskopi, perubahan energi yang terjadi saat elektron berpindah antar tingkat energi yang berbeda direpresentasikan dalam bentuk garis spektrum. Setiap garis spektrum memiliki panjang gelombang atau frekuensi tertentu yang berkaitan dengan perubahan bilangan kuantum.
Hasil dan Kesimpulan
Dalam penelitian spektroskopi, bilangan kuantum digunakan untuk mengidentifikasi setiap garis spektrum yang dihasilkan saat atom atau molekul berinteraksi dengan radiasi elektromagnetik. Spektrum yang dihasilkan dapat memberikan informasi penting tentang sifat-sifat materi yang diteliti, seperti komposisi kimia dan suhu. Dengan memahami dan menerapkan konsep bilangan kuantum, ilmuwan dapat menganalisis dan menginterpretasikan spektrum dan menggunakan informasi tersebut untuk memahami struktur atom dan molekul secara lebih mendalam.
Kesimpulan
Dalam fisika, bilangan kuantum digunakan untuk menggambarkan keadaan energi, gerak, dan orbital elektron dalam atom. Terdapat empat jenis bilangan kuantum utama yang umum digunakan, yaitu bilangan kuantum utama (n), azimutal (l), magnetik (m), dan spin (s). Bilangan kuantum ini memberikan informasi yang penting dalam memahami struktur atom dan memprediksi perilaku partikel subatomik. Dalam penerapan fisika dalam kehidupan sehari-hari, bilangan kuantum juga digunakan dalam bidang seperti kimia, spektroskopi, dan banyak lagi.


