Pasangan Larutan Berikut Yang Tergolong Elektrolit Lemah Adalah
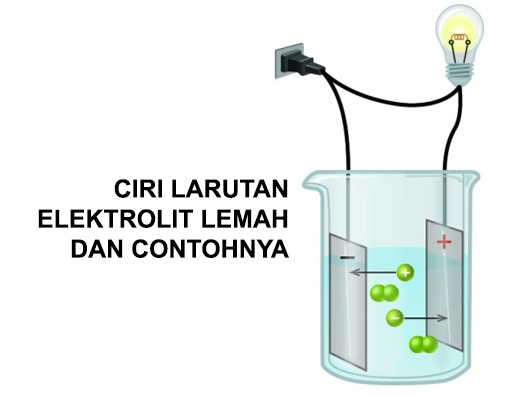
Apa itu elektrolit lemah? Elektrolit lemah adalah jenis larutan yang memiliki keelektronegatifan rendah sehingga memiliki kecenderungan rendah untuk membentuk ion-ion dalam
larutan tersebut. Ketika larutan elektrolit lemah dilarutkan dalam pelarut, hanya sebagian kecil molekul yang terdisosiasi menjadi ion-ion, sedangkan sebagian besar tetap
berbentuk molekul utuh. Contoh larutan elektrolit lemah umum meliputi asam karbonat (H2CO3), asam asetat (CH3COOH), dan asam sulfat (H2SO4).
Elektrolit lemah bisa diklasifikasikan berdasarkan tingkat disosiasinya, yaitu elektrolit lemah yang sepenuhnya atau hampir sepenuhnya terdisosiasi disebut elektrolit lemah kuat,
sedangkan elektrolit lemah yang hanya terdisosiasi sebagian saja disebut elektrolit lemah sejati. Elektrolit lemah sejati memiliki konduktivitas listrik yang lebih rendah
dibandingkan elektrolit kuat. Sifat ini disebabkan oleh keterbatasan jumlah ion dalam larutan elektrolit lemah sejati.
LARUTAN ELEKTROLIT
Elektrolit adalah senyawa kimia yang ketika dilarutkan dalam pelarut seperti air, membentuk ion-ion yang dapat menghantarkan listrik. Larutan elektrolit umumnya terdiri dari
senyawa ionik seperti garam dan asam, namun ada juga senyawa kovalen yang mampu berfungsi sebagai elektrolit, seperti asam kuat.
Larutan elektrolit penting dalam berbagai aspek kehidupan sehari-hari. Dalam bidang industri, larutan elektrolit sering digunakan dalam proses-proses kimia dan pemurnian logam.
Dalam bidang medis, larutan elektrolit digunakan dalam infus untuk mengganti cairan tubuh dan memulihkan keseimbangan elektrolit. Selain itu, larutan elektrolit juga penting
dalam proses-proses biokimia di dalam tubuh manusia.
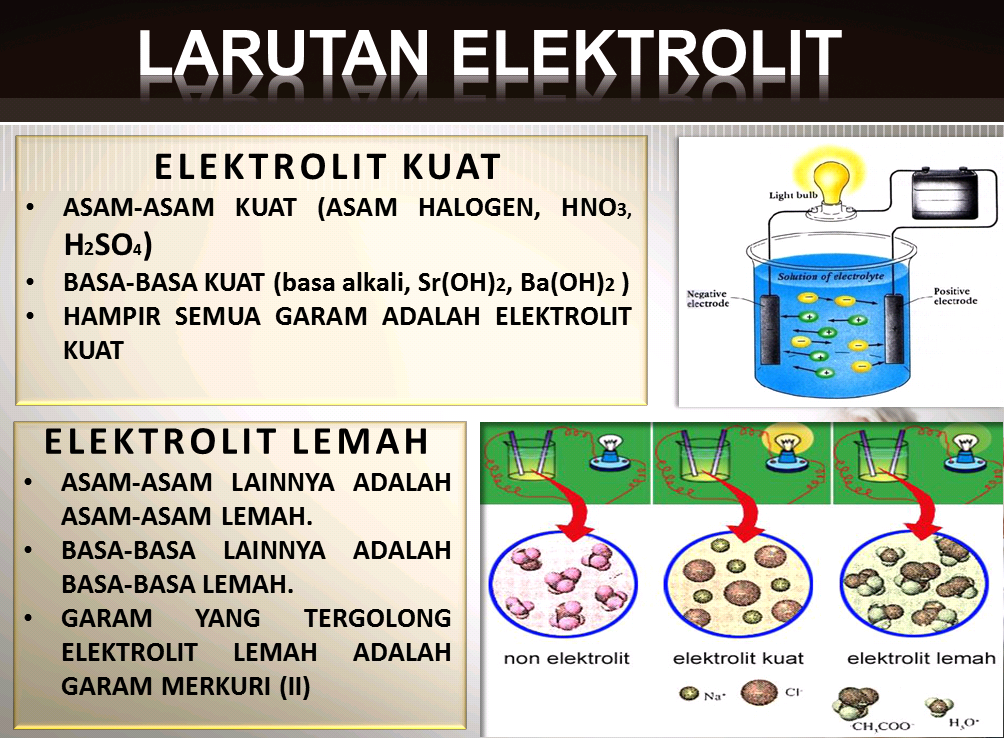
Larutan elektrolit dapat dibedakan menjadi dua jenis, yaitu elektrolit kuat dan elektrolit lemah. Elektrolit kuat adalah senyawa yang sepenuhnya atau hampir sepenuhnya terionisasi
dalam larutan, sehingga menghasilkan kecenderungan tinggi untuk menghantarkan arus listrik. Biasanya, elektrolit kuat terdiri dari senyawa ionik yang dapat memisahkan atom-atomnya
menjadi ion-ion bebas saat dilarutkan. Sedangkan elektrolit lemah adalah senyawa yang hanya terionisasi sebagian dalam larutan, sehingga memiliki tingkat disosiasi yang lebih rendah
dibandingkan elektrolit kuat.
Perhatikan gambar dua larutan berikut! 200 ML larutan HCL…

Apa itu larutan elektrolit? Larutan elektrolit adalah larutan yang mengandung ion-ion yang dapat menghantarkan arus listrik. Ion-ion dalam larutan elektrolit dapat berasal dari
senyawa ionik maupun senyawa kovalen yang terionisasi saat dilarutkan dalam pelarut. Seperti yang terlihat pada gambar di atas, larutan HCl dalam botol pertama (kiri)
akan menghasilkan ion-ion hidrogen (H+) dan ion klorida (Cl–) saat dilarutkan dalam air. Sedangkan larutan asam asetat dalam botol kedua (kanan)
hanya sedikit menghasilkan ion-ion asetat (CH3COO–).
Larutan HCl merupakan contoh larutan elektrolit kuat karena hampir seluruh molekul HCl terionisasi dalam larutan, sehingga menghasilkan banyak ion-ion. Sebaliknya,
larutan asam asetat adalah contoh larutan elektrolit lemah karena hanya sebagian molekul asam asetat yang terionisasi. Kekuatan elektrolit lemah dapat diketahui melalui
tingkat disosiasi, yaitu persentase molekul yang terionisasi dalam larutan. Semakin tinggi tingkat disosiasi, maka semakin kuat elektrolit tersebut.
…


