Salah satu materi yang mungkin sudah pernah kamu pelajari di sekolah adalah sel elektrolisis atau sel galvani. Dalam pembelajaran kali ini, kita akan membahas lebih mendalam tentang sel elektrolisis, apa itu, mengapa sel ini penting, cara kerjanya, dan beberapa contoh soal yang bisa kamu coba.
Apa Itu Sel Elektrolisis?
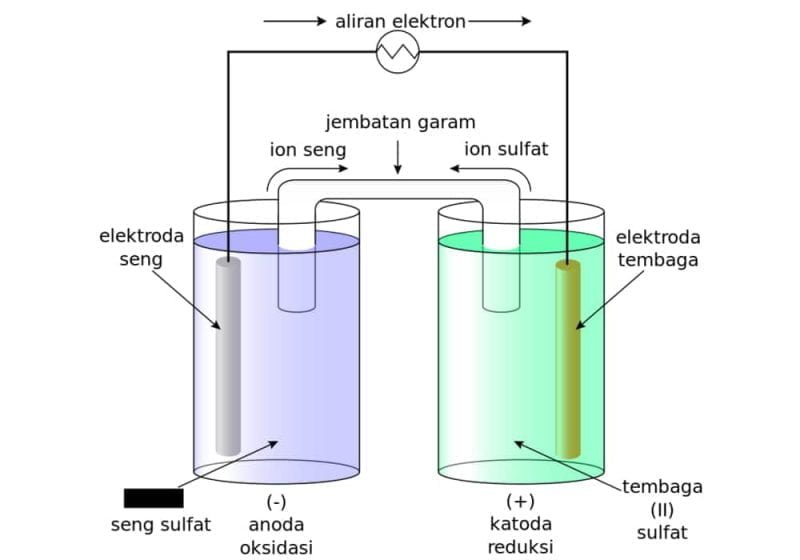
Sel elektrolisis adalah sebuah sel elektrokimia yang digunakan untuk memecah atau menghasilkan senyawa kimia dengan bantuan arus listrik. Dalam proses ini, senyawa yang akan dipecah atau dihasilkan diletakkan di antara dua elektroda yang terhubung dengan kabel. Satu elektroda disebut anoda (biasanya berupa logam) dan yang satu lagi disebut katoda (biasanya terbuat dari platina atau karbon).
Mengapa Sel Elektrolisis Penting?
Sel elektrolisis memainkan peran penting dalam banyak aplikasi industri. Beberapa contohnya adalah:
- Pembuatan logam murni seperti tembaga dan aluminium
- Pewarnaan logam seperti pada perhiasan
- Pembuatan klorin dan natrium hidroksida yang digunakan dalam produksi pupuk dan deterjen
Cara Kerja Sel Elektrolisis
Proses kerja sel elektrolisis cukup sederhana. Arus listrik mengalir melalui elektrolit (senyawa yang akan dipecah atau dihasilkan) untuk mencapai anoda dan katoda. Di anoda, senyawa yang digunakan akan mengalami oksidasi (kehilangan elektron) dan menjadi ion positif. Di sisi lain, di katoda, elektron akan diterima oleh senyawa dan menjadi ion negatif. Ion-ion positif dan negatif ini akan bertemu dan membentuk senyawa hasil elektrolisis.
Contoh Soal Sel Elektrolisis
Soal 1
Berapa banyak logam tembaga yang dihasilkan dari elektrolisis 200 gram CuSO4 jika kuat arus listrik yang digunakan adalah 2 Ampere dan waktu elektrolisis adalah 60 menit?
Jawab:
1 Faraday = 96.500 Coulomb
1 Mol e- = 96.500 Coulomb (atau 1 Faraday)
1 Mol Cu = 2 Mol e-
Molar Mass CuSO4 = 159,6 g/mmol
Kuanta elektron (Q) = i.t dimana :
- i = kuat arus
- t = lama elektrolisis
Dalam satu mol CuSO4 ada 2 mol elektron, sehingga:
Q = i.t/molar_mass_cuSO4 x 2 mol elektorn/mol e-
Q = 2 Amp x 3600 s x 200 g / 159,6 g/mol / 96.500 Coulomb/mol = 0.00158 mol Cu
Molar Mass Cu = 63,546 g/mol
Massa Cu yang dihasilkan = mol Cu x molar_mass_cu = 0.00158 mol x 63,546 g/mol = 0.1002 g
Jadi, massa logam tembaga yang dihasilkan adalah sekitar 0.1 gram.
Soal 2
Sebuah larutan NH4Cl 0,1 M dipecah ketika dialiri arus listrik selama 10 menit dengan arus 5 A. Berapa banyak gas yang dihasilkan pada katoda?

Jawab:
Arus listrik (I) = 5 A
Waktu elektrolisis (t) = 10 menit = 600 detik
NH4Cl = 0,1 M
Kita harus menghitung jumlah gas yang dihasilkan pada katoda, yang merupakan tempat di mana reduksi terjadi.
Proses reduksi senyawa NH4Cl menghasilkan NH3 dan H2O. Kita akan memusatkan perhatian pada gas hidrogen yang dihasilkan:
NH4+ (aq) + e- → NH3 (g) + H2O (l)
Kita tahu arus yang mengalir melalui sel, jadi kita dapat menghitung jumlah coulomb yang digunakan:
Q = I x t = 5 A x 600 s = 3000 C
Kita juga tahu jumlah elektron yang digunakan sekunder, yakni sebesar 1 molekul air (H2O) yang diperoleh dari tahanan koefisien, yakni:
Q = z x F
Q = jumlah coulomb di sel
z = tahanan koefisien
F = faraday (konstanta 96500 C/mol elektron)
Karena kita tidak tahu tahanan koefisien NH4Cl yang diuraikan, maka kita akan menghitung berapa moles elektron yang dipindahkan dalam proses reduksi H+ menjadi H2 gas.
Jumlah elektron yang dihasilkan oleh 5 A selama 10 menit adalah:
5 A x 600 s = 3,000 C
Jumlah elektron = Q/F = 3,000 C/96,500 C/mol elektron = 0,031 mol elektron
Jadi, jumlah H2 yang diproduksi adalah 0,031 mol. Karena 1 mol hidrogen menghasilkan 1 molekul H2, maka jumlah H2 yang dihasilkan adalah sama dengan jumlah mol H2, yakni 0,031 mol.
Itulah beberapa contoh soal sel elektrolisis dan cara menghitungnya. Jangan ragu untuk mempraktikkannya di rumah atau bertanya pada guru biologi atau kimia Anda jika Anda masih kesulitan dalam memahami materi ini.





