Bukan rahasia lagi bahwa belajar kimia memang sangat membutuhkan usaha dan kesabaran yang besar. Dalam ilmu kimia, ada banyak sekali konsep-konsep yang harus dipelajari, dari mulai konsep asam-basa, reaksi redoks, termokimia, hingga hukum Hess.
Contoh Soal Termokimia Beserta Jawabannya
Salah satu konsep dalam kimia yang seringkali membuat kita bingung adalah termokimia. Termokimia merupakan cabang ilmu kimia yang mempelajari hubungan antara reaksi kimia dengan panas yang dilepaskan atau diserap oleh sistem.

Apa itu Termokimia?
Sebelum membahas contoh soal termokimia, mari kita bahas dulu apa itu termokimia. Semua reaksi kimia pada dasarnya akan melepaskan atau menyerap panas dari lingkungan sekitarnya. Reaksi yang melepaskan panas disebut reaksi eksotermik, sedangkan reaksi yang menyerap panas disebut reaksi endotermik.
Mengapa Termokimia Penting?
Termokimia sangat penting dalam kehidupan sehari-hari. Salah satunya adalah pada pembakaran bahan bakar. Ketika kita membakar bahan bakar (seperti kayu atau minyak), maka terjadi reaksi eksotermik, dimana panas dilepaskan dan menghasilkan energi panas. Energi panas yang dihasilkan ini digunakan untuk memasak, menghangatkan rumah, dan sebagainya.
Cara Menghitung Termokimia?
Untuk menghitung termokimia, kita harus mengetahui entalpi pembentukan (ΔHf) dari masing-masing senyawa. Entalpi pembentukan adalah jumlah energi yang dilepaskan atau diserap ketika 1 mol senyawa terbentuk dari unsur-unsurnya pada keadaan standar.
Contoh Soal Termokimia
Misalkan terdapat reaksi antara pembakaran metana (CH4) dengan oksigen (O2) yang menghasilkan karbon dioksida (CO2) dan air (H2O). Dalam reaksi ini, panas dilepaskan sebanyak 802 kJ/mol.
Contoh Soal Hukum Hess Dan Penyelesaiannya
Setelah membahas termokimia, kini saatnya kita membahas konsep hukum Hess. Hukum Hess merupakan hukum yang menyatakan bahwa entalpi reaksi bersifat aditif. Artinya, jumlah entalpi dari beberapa reaksi kimia disebutkan sama dengan entalpi hasil reaksi akhir.
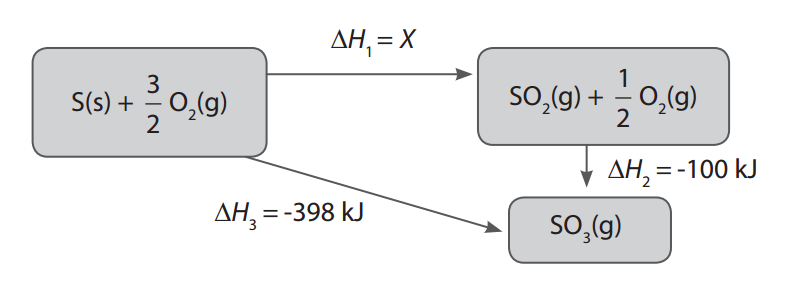
Apa itu Hukum Hess?
Ketika suatu senyawa dibakar, reaksi yang terjadi bergantung pada unsur-unsur yang terlibat dalam reaksi tersebut. Namun, entalpi yang dihasilkan dari reaksi tersebut bergantung hanya pada senyawa-senyawa yang berperan secara langsung dalam reaksi tersebut.
Mengapa Hukum Hess Penting?
Hukum Hess merupakan salah satu hukum yang paling penting dalam kimia. Hukum ini memungkinkan kita untuk menghitung perbedaan entalpi reaksi, tanpa perlu mengukur entalpi langsung dari reaksi tersebut. Dengan cara ini, kita dapat menghemat waktu dan biaya dalam melakukan penelitian atau percobaan.
Cara Menghitung Hukum Hess?
Untuk menghitung hukum Hess, kita harus mengetahui entalpi pembentukan dari masing-masing senyawa yang terlibat dalam reaksi. Dalam kasus ini, kita akan menggunakan contoh soal berikut:
Reaksi 1: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔH1 = -890 kJ/mol
Reaksi 2: C(s) + O2(g) → CO2(g) ΔH2 = -394 kJ/mol
Reaksi 3: H2(g) + 1/2O2(g) → H2O(l) ΔH3 = -286 kJ/mol
Contoh Soal Hukum Hess:
Hitunglah entalpi pembakaran karbon (C) untuk menghasilkan karbon dioksida (CO2) dengan menggunakan hukum Hess.
Penyelesaiannya:
1. Balikan reaksi pembentukan karbon monoksida (CO) dengan persamaan:
CO2(g) → C(s) + O2(g) ΔH = +394 kJ/mol
2CO(g) + O2(g) → 2CO2(g) ΔH = -566 kJ/mol
Berdasarkan hukum Hess:
Hukum Hess : ΔH1 = -ΔH2
ΔH pembakaran karbon (C) dapat dihitung dengan:
C(s) + O2(g) → CO2(g) ΔH = ΔH pembentukan karbon dioksida (CO2) – ΔH pembentukan karbon monoksida (CO) = -394 kJ/mol – (-566 kJ/mol) = 172 kJ/mol
Dengan demikian, ΔH pembakaran karbon (C) adalah 172 kJ/mol.
Sekarang kamu sudah paham dengan konsep termokimia dan hukum Hess kan? Jangan lupa untuk selalu belajar dan berlatih diiringi dengan kesabaran dan tekad yang kuat. Semoga informasi ini bermanfaat untuk kamu!




